
【题目】N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N_____O(填“![]() ”或“
”或“![]() ”,下同),电负性:S____Cl。
”,下同),电负性:S____Cl。
(2)![]() 的沸点比
的沸点比![]() 高的原因是___________;
高的原因是___________;![]() 属于________(填“极性”或“非极性”)分子,
属于________(填“极性”或“非极性”)分子,
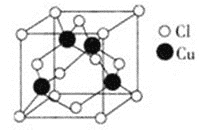
(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为________。
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是![]()
A.在![]() 溶液中投入足量的Zn粉:
溶液中投入足量的Zn粉:![]()
B.![]() 溶液与
溶液与![]() 溶液混合后呈中性:
溶液混合后呈中性:![]()
C.磁性氧化铁![]() 溶于氢碘酸:
溶于氢碘酸:![]()
D.![]() 溶液中通入少量
溶液中通入少量![]() :
:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
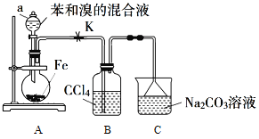
【题目】溴苯是一种重要化工原料,实验室制备溴苯的反应装置如图所示,有关数据如下:
苯 | 溴 | 溴苯 | |
相对分子质量 | 78 | 160 | 157 |
密度/gcm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)仪器a的名称为________
(2)在A装置中加入7.8 mL无水苯、适量液态溴和少量铁屑。实验时装置B中可能的现象为_____,装置C的作用是___________。
(3)反应充分后,取A装置中反应液,经过下列步骤分离提纯:
①向其中加入适量___(填试剂名称),然后____(填操作名称)除去未反应的铁屑;
②滤液依次用水、l0%的NaOH溶液、水洗涤。NaOH溶液洗涤的作用是____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经以上分离操作后,粗溴苯中还含有一定量的杂质,要进一步提纯,下列仪器在该提纯步骤中没有使用到的是____(填入正确选项前的字母)。
A.  B.
B.  C.
C. ![]() D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
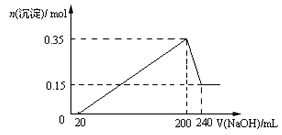
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
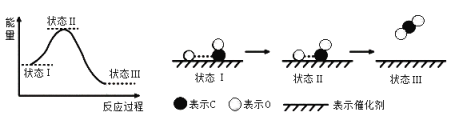
下列说法中正确的是
A.在该过程中,CO断键形成C和O
B.CO和O生成了具有共价键的CO2
C.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
D.CO和O生成CO2是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与![]() 是常用的火箭推进剂,二者发生如下化学反应:
是常用的火箭推进剂,二者发生如下化学反应:
![]()
![]()
(1)火箭残骸中常现红棕色气体,原因为:![]()
![]()
当温度升高时,气体颜色变深,则反应![]() 为____
为____![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
(2)在一个体积为1L的恒压密闭容器中充入![]() ,一段时间后达化学平衡状态,反应的化学平衡常数表达式
,一段时间后达化学平衡状态,反应的化学平衡常数表达式![]() _________;反应3s后
_________;反应3s后![]() 的物质的量为
的物质的量为![]() ,则
,则![]() 内的平均反应速率
内的平均反应速率![]() ______
______
(3)在![]() 的平衡体系中,回答下列问题:
的平衡体系中,回答下列问题: ![]() 填“正向”、“逆向”、“不”
填“正向”、“逆向”、“不”![]()
①在溶液中加入少量的KSCN固体,平衡____移动。
②在溶液中加入少量的NaOH固体,平衡_____移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以海水晒盐后的苦囟![]() 含有
含有![]() 为原料,设计制备碘单质
为原料,设计制备碘单质![]() 的转化途径如图,下列说法不正确的是
的转化途径如图,下列说法不正确的是

A.生活中可直接使用![]() 淀粉试纸检验加碘盐中是否含有碘
淀粉试纸检验加碘盐中是否含有碘
B.途径Ⅲ发生反应的离子方程式可能是![]()
C.由图可知氧化性的强弱顺序为![]()
D.两种途径得到等量的碘,消耗氯气物质的量比为1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如下图所示的实验装置(固定装置已略去)。

①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_______(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是___________________;装置D的作用是___________________。
③装置C中发生反应的化学方程式为________________________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_____________________________。
⑤该装置存在的主要缺陷是___________________________________________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。

①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是___________,U型管中加入的试剂是___________。
②此装置能产生大量氨气的原因是___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com