
【题目】(1)将金属钠放入硫酸铜溶液中会产生蓝色沉淀,反应的化学方程式 ________________
(2)过氧化钠与水反应的化学方程式:_________
(3)铁在氯气中燃烧反应的化学方程式:____________
(4)氯气和水反应的化学方程式:_____________
【答案】2Na+2H2O=2NaOH+H2↑、2NaOH+ CuSO4 =Cu(OH)2↓+ Na2SO4 2Na2O2+2H2O=4NaOH+O2↑ 2Fe+3Cl2![]() 2FeCl3 Cl2+H2O = HCl+HClO
2FeCl3 Cl2+H2O = HCl+HClO
【解析】
(1)金属钠放入硫酸铜溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铜反应生成氢氧化铜蓝色沉淀,反应的化学方程式为:2Na+2H2O=2NaOH+H2↑、2NaOH+ CuSO4 =Cu(OH)2↓+ Na2SO4;
(2)过氧化钠和水发生歧化反应生成氢氧化钠和氧气:2Na2O2+2H2O=4NaOH+O2↑;
(3)氯气的氧化性比较强,所以铁在氯气中燃烧生成FeCl3:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(4)氯气和水发生歧化反应生成盐酸和次氯酸:Cl2+H2O = HCl+HClO。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、R、T 的原子序数依次增大, X 的最外层电子数与次外层电子数相等, X、 W位于同族。Y和Z的价电子数之和等于R和T的最外层电子数之和,这四种元素组成两种盐Z2TY3和ZRY2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是

A. 简单离子的半径:r(Y)<r(Z)<r(W)
B. 气态氢化物的热稳定性: T > Y
C. 工业上电解R的氯化物冶炼单质R
D. X的氢氧化物既可与强酸反应,又可与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,相同体积、相同pH的氨水和NaOH溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
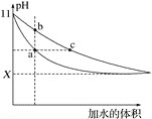
A. 处于a点溶液的导电能力比处于b点溶液的导电能力强
B. 对于b、c两点,氨水的电离常数Kb>Kc
C. 若取相同体积的处于a点和c点的溶液分别与同浓度的盐酸完全反应,消耗盐酸的体积Va<Vc
D. X的值接近7,但小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年报道了使用α-溴代羰基化合物合成大位阻醚和硫醚的有效方法,可用于药物化学和化学生物学领域。用此法合成化合物J的路线如下:

已知:
回答下列问题:
(1)A的结构简式为____________。D中含有的官能团名称是____________。
(2)由B生成C的化学方程式是______________________。
(3)C→D所需试剂和反应条件为_____________________。
(4)G的化学名称为_____________,F+H→J的反应类型是___________。
(5)F与C在CuBr和磷配体催化作用下也可合成大位阻醚,写出一种有机产物的结构简式:_____________。
(6)化合物X是E的同分异构体,分子中不含羧基,既能发生水解反应,又能与金属钠反应。符合上述条件的X的同分异构体有_____种(不考虑立体异构),其中能发生银镜反应,核磁共振氢谱有3组峰,峰面积之比为1:1:6的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是( )
A.Na2CO3和Na2O2B.只有Na2CO3
C.Na2CO3和NaOHD.Na2O和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将水置于足够强的电场中,在20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性KMnO4溶液褪色,且有气泡产生。将酸性KMnO4溶液换成FeCl3溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是( )

A. 20℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3溶液时,产生的气体为Cl2
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国夏威夷联合天文中心的科学家发现了新的氢微粒,该微粒是由3个氢原子核(只含质子)和2个电子构成,关于这种微粒的下列说法中正确的是
A. 是氢元素的一种新的同素异形体
B. 是氢元素的一种新的同位素
C. 该微粒的组成可用H3表示
D. 该微粒比普通氢分子多一个氢原子核
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com