
【题目】将0.2mol AgNO3、0.4mol Cu(NO3)2、0.6mol KCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3mol Cu,此时在另一极上产生的气体体积(标准状况)为( )
A.3.36 L
B.4.48 L
C.5.6 L
D.6.72 L
【答案】C
【解析】解:混合溶液中发生的反应为AgNO3+KCl=AgCl+KNO3,根据方程式知,0.2molAgNO3完全反应需要0.2molKCl,还剩余0.4molKCl,且同时生成0.2molKNO3,所以混合后溶液中的溶质为0.2mol KNO3、0.4mol Cu(NO3)2、0.4mol KCl,用惰性电极电解一段时间后,若在一极析出Cu0.3mol<0.4mol,根据Cu和转移电子之间的关系式知,转移电子的物质的量=2n(Cu)=2×0.3mol=0.6mol,氯离子完全放电时转移电子物质的量=0.4mol×1=0.4mol,则还有0.2mol电子转移时生成氧气,则生成n(O2)= ![]() =0.05mol,生成n(Cl2)=
=0.05mol,生成n(Cl2)= ![]() n(Cl﹣)=
n(Cl﹣)= ![]() ×0.4mol=0.2mol,生成气体V=nVm=(0.2+0.05)mol×22.4L/mol=5.6L,
×0.4mol=0.2mol,生成气体V=nVm=(0.2+0.05)mol×22.4L/mol=5.6L,
故选C.


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 电离时能产生的阳离子是氢离子的化合物一定是酸
B. 所有盐电离时一定产生酸根阴离子和金属阳离子
C. 酸性氧化物是指能与水反应生成酸的化合物,如CO2、SO3
D. 碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在.某工厂处理氨氮废水的流程如下: 含NH4+的废水 ![]() 低浓度氨氮废水
低浓度氨氮废水 ![]() 含余氯废水
含余氯废水 ![]() 达标废水
达标废水
(1)I中加入NaOH溶液,调pH=11并鼓入大量空气.用离子方程式表示加NaOH溶液的作用是;鼓入大量空气的目的是 .
(2)II中加入适量NaClO溶液,控制pH在6~7,将氨氮转化为无毒物质. ①为了完全从废水中去除氨氮,加入的NaClO与水体中NH4+的物质的量之比最小是 .
②过程 II发生3个反应:
i.ClO﹣+H+═HClO
ii.NH4++HClO═NH2Cl+H++H2O (NH2Cl中Cl元素为+1价)
iii. …
已知:水体中以+1价形式存在的氯元素有消毒杀菌的作用,被称为“余氯”.图为NaClO加入量与“余氯”含量的关系示意图.其中氨氮含量最低的点是c点.
b点表示的溶液中氮元素的主要存在形式是(用化学式表示);反应iii的化学方程式是 . 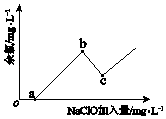
(3)III中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mgL﹣1 . 若含余氯废水中NaClO的含量是7.45mgL﹣1 , 则处理10m3含余氯废水,至多添加10% Na2SO3溶液kg(溶液体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.合成纤维和人造纤维统称为化学纤维
B.聚氯乙烯是热固性塑料
C.锦纶丝接近火焰时先蜷缩,燃烧时有烧焦羽毛的气味,灰烬为有光泽的硬块,能压成粉末
D.对于某些合成材料和塑料制品废弃物的处理可以倾倒到海洋中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀地分散到蒸馏水中,得到的物质①是溶液②是胶体③具有丁达尔效应④静置后会出现黑色沉淀⑤不能透过滤纸。其中正确的是
A.①④B.②③⑤C.②③D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不另用任何试剂就能将下列四种溶液:①CuSO4、②Na2SO4、③KCl、④BaCl2鉴别出来,其正确的鉴别顺序是 ( )
A.①②④③B.④③②①C.①④②③D.②①④③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中乙是甲的电解池进行电解时的某个量(纵坐标x)随时间变化的曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),则x表示( ) 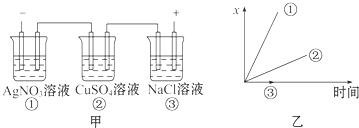
A.各电解池析出气体体积总数的变化
B.各电解池阳极质量的增加
C.各电解池阴极质量的增加
D.各电极上放电的离子总数的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图中氮元素及其化合物的转化关系,回答问题:
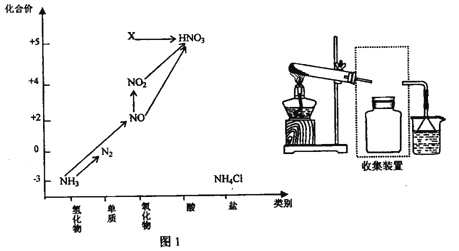
(1)实验窒常用NH4Cl 与Ca(OH)2制取氨气,该反应的化学方程式为___________。
(2)若要收集一瓶氨气,请将下列装置补充完整,在虚框内画出连接图。___________
(3)下列试剂不能用手干燥NH3的是_________。
A.浓硫酸 B.碱石灰 C.NaOH 固体
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO 化学方程式为____________。
②NO→NO2 实验现象是_______ 。
③ NO2![]() HNO3 氧 化剂 与 还原剂物质的量之比为_______。
HNO3 氧 化剂 与 还原剂物质的量之比为_______。
(5)图1中,实验室只用一种物质将NO 直接转化为硝酸且绿色环保,则该物质的化学式为_____________,
(6) 图1中,X的化学式为__________,从物质性质上看,X 属于_______氧化物。
(7)若要将NH3→N2,,从原理上看,下列试剂可行的是_______。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏伽德罗常数,则关于热化学方程式:C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l)△H=﹣1300kJmol﹣1的说法中,正确的是( )
O2(g)═2CO2(g)+H2O(l)△H=﹣1300kJmol﹣1的说法中,正确的是( )
A.当有6 NA个电子转移时,该反应放出1300 kJ的能量
B.当有NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com