
【题目】非金属单质A经图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题: A ![]() B
B ![]() C
C ![]() D
D
(1)若A在常温下为固体单质,B是能使品红溶液褪色的有刺激性气味的无色气体. ①写出B→C的化学方程式
②写出D→B的化学方程式
(2)若A在常温下为气体单质,C是红棕色气体. ①A、C的化学式分别是:A;C .
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的离子方程式 .
(3)若A在常温下为非金属气态氢化物,C是红棕色气体.写出实验室制取A气体的化学方程式 .
【答案】
(1)2SO2+O2 ![]() 2SO3;Cu+2HSO4(浓)
2SO3;Cu+2HSO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)N2;NO2;Cu+4H++4NO3﹣═Cu2++2NO3﹣+2NO2↑+2H2O
(3)2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
【解析】解:非金属单质A能发生连续氧化,且最终得含氧酸D为强酸,中学中硫和氮元素化合物符合转化关系.(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体,则A为S元素,B为SO2 , C为SO3 , D为H2SO4 , ①B→C的化学方程式:2SO2+O2 ![]() 2SO3 , ②D→B的化学方程式:Cu+2HSO4(浓)
2SO3 , ②D→B的化学方程式:Cu+2HSO4(浓) ![]() CuSO4+SO2↑+2H2O等,所以答案是:2SO2+O2
CuSO4+SO2↑+2H2O等,所以答案是:2SO2+O2 ![]() 2SO3;Cu+2HSO4(浓)
2SO3;Cu+2HSO4(浓) ![]() CuSO4+SO2↑+2H2O;(2)若A在常温下为气体单质,C是红棕色气体,则A为N2 , B为NO,C为NO2 , D为HNO3;①A、C的化学式分别是:N2、NO2 , 所以答案是:N2;NO2;②D的浓溶液在常温下可与铜反应并生成C气体,该反应的离子方程式:Cu+4H++4NO3﹣═Cu2++2NO3﹣+2NO2↑+2H2O, 所以答案是:Cu+4H++4NO3﹣═Cu2++2NO3﹣+2NO2↑+2H2O;(3)若A在常温下为气态化合物,C是红棕色的气体,则A应为NH3 , B为NO,C为NO2 , D为HNO3 , 实验室制取氨气的反应方程式为:2NH4Cl+Ca(OH)2
CuSO4+SO2↑+2H2O;(2)若A在常温下为气体单质,C是红棕色气体,则A为N2 , B为NO,C为NO2 , D为HNO3;①A、C的化学式分别是:N2、NO2 , 所以答案是:N2;NO2;②D的浓溶液在常温下可与铜反应并生成C气体,该反应的离子方程式:Cu+4H++4NO3﹣═Cu2++2NO3﹣+2NO2↑+2H2O, 所以答案是:Cu+4H++4NO3﹣═Cu2++2NO3﹣+2NO2↑+2H2O;(3)若A在常温下为气态化合物,C是红棕色的气体,则A应为NH3 , B为NO,C为NO2 , D为HNO3 , 实验室制取氨气的反应方程式为:2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑,
CaCl2+2H2O+2NH3↑,
所以答案是:2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑.
CaCl2+2H2O+2NH3↑.


科目:高中化学 来源: 题型:
【题目】已知A、B、C均为短周期元素形成的单质,且元素A、B同周期,A元素原子半径大于B元素原子半径,在一定条件下单质A和单质B、单质A和C都按物质的量2:1反应,分别生成X和Y,在产物中B、C两元素呈负价. 分别取3份完全相同且质量均为1.52g由单质A和单质B组成的混和物进行下列实验:
①在第一份样品中加入过量盐酸,充分搅拌后在标准状况下放出0.896L H2 , 残留不溶于酸的固体0.56g
②在第二份样品中加入过量浓NaOH溶液,微热充分反应后在标准状况下放出0.896L H2残留不溶于碱的固体0.96g
③将第三份样品隔绝空气加强热生成化合物X,将X投入稀盐酸中,X溶解且放出在空气中能自燃的气体a L
根据上述题给信息和实验记录解答下列问题
(1)写出下列元素的名称:A:;C:;
(2)混和物中B的质量分数是:
(3)计算:a= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学物I是治疗失眠症药物雷美替胺的中间体,其合成路线如下: 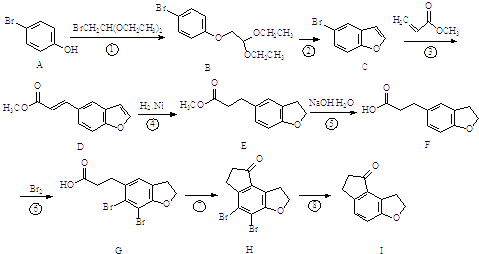
(1)反应①的类型为: , 反应④的类型为: .
(2)物质F中含氧官能团的名称为 .
(3)反应③会生成与D互为同分异构体的副产物,该反应的方程式为 .
(4)若未设计反应⑥,则化合物I中可能混有杂质,该杂质同样含有一个六元环和两个五元环,其结构简式为 .
(5)写出同时满足下列条件的物质I的一种同分异构体的结构简式 . ①能发生银镜反应;②能发生水解反应;③分子的核磁共振氢谱有5个峰.
(6)已知:CH2=CHCH2OH ![]() CH2=CHCOOH 以CH2=CHCH=CH2、
CH2=CHCOOH 以CH2=CHCH=CH2、 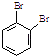 为原料,合成
为原料,合成 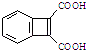 ,写出合成流程图(无机试剂任用).合成
,写出合成流程图(无机试剂任用).合成
流程图示例如下:CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH. .
CH3CH2OH. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的侯氏制碱法为世界制碱工业作出了突出贡献。他以NaCl、NH3、CO2等为原料制得NaHCO3 , 进而生产出纯碱,有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3![]() Na2CO3+CO2↑+H2O↑
Na2CO3+CO2↑+H2O↑
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________(填字母标号)。
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方法实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出):
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是;
(Ⅱ)丁装置中稀硫酸的作用是。
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是(填分离操作的名称)。
②另一位同学用下图中戊装置(其他装置未画出)进行实验:
(Ⅰ)实验时,须先从管通入气体,再从管通入气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,原因是。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子能大量共存的是( )
A. H+、Na+、NO3-、SO32-B. NH4+、K+、Cl-、OH-
C. Fe3+、NH4+、NO3-、SO42-D. K+、Fe3+、SO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、W、X、Y、Z在元素周期表中的对应位置如图所示,其中只有Z为金属元素.下列说法正确的是( ) 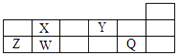
A.W、X两元素在自然界中都存在相应的单质
B.Q、Y分别与钠元素形成的化合物中仅含离子键
C.简单离子半径由大到小的顺序为:Q>Y>Z
D.X、Z的最高价氧化物对应的水化物之间易发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知H2CO3H++HCO3﹣K1=4.3×l0﹣7;
HCO3﹣H++CO32﹣K2=5.6×l0﹣11;
H2OH++OH﹣Kw=1.0×l0﹣14
现取10.6g Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )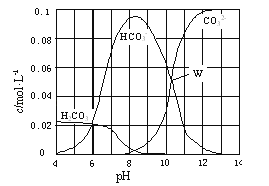
A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
B.pH=4的溶液中:c(H2CO3)+c(HCO3﹣)+c(CO32﹣)=0.1 molL﹣1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3﹣)=c(OH﹣)+c(Cl﹣)
D.pH=11的溶液中:CO32﹣+H2OHCO3﹣+OH﹣K=1.8×l0﹣4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为﹣285.5kJ/mo1,则电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5kJ/mo1
B.1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,则它的热化学方程式为: ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(1)△H=﹣445kJ/mol
CO2(g)+H2O(1)△H=﹣445kJ/mol
C.已知:2C(s)+O2(g)=2CO(g)△H=﹣221 kJmol﹣1 , 则C的燃烧热为﹣110.5kJ/mo1
D.HF与NaOH溶液反应:H+(aq)+OH﹣(aq)=H2O(1)△H=﹣57.3kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com