
【题目】非金属元素在化学中具有重要地位,请回答下列问题:
(1)氧元素的第一电离能比同周期的相邻元素要小,理由________。
(2)元素X与硒(Se)同周期,且该周期中X元素原子核外未成对电子数最多,则X为_____(填元素符号),其基态原子的电子排布式为_______。
(3)臭齅排放的臭气主要成分为3-MBT-甲基2丁烯硫醇,结构简式为(![]() )1mol 3-MBT中含有
)1mol 3-MBT中含有![]() 键数目为_______NA(NA为阿伏伽德罗常数的值)。该物质沸点低于(CH3)2C=CHCH2OH,主要原因是_______。
键数目为_______NA(NA为阿伏伽德罗常数的值)。该物质沸点低于(CH3)2C=CHCH2OH,主要原因是_______。
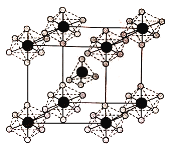
(4)PCl5是一种白色晶体,熔融时形成一种能导电的液体测得其中含有一种正四面体形阳离子和一种正八面体形阴离子;熔体中P-Cl的键长只有198pm和206pm两种,试用电离方程式解释PCl5熔体能导电的原因_________,正四面体形阳离子中键角大于PCl3的键角原因为__________,该晶体的晶胞如图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_______g/cm 3
【答案】F对最外层电子的吸引力比O强,N原子核外电子处于半满的较稳定状态,故第一电离能均高于O Cr 1s22s22p63s23p63d54s1或[Ar]3d54s1 15 (CH3)2C=CHCH2OH分子间含有氢键,增大分子间的作用力,使沸点升高 2 PCl5 = PCl4++PCl6- PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对。孤电子对对成键电子的排斥力大于成键电子对间的排斥力 ![]() 或
或![]()
【解析】
(1)F对最外层电子的吸引力比O强,N原子核外电子处于半满的较稳定状态;
(2)元素X与(Se)同周期,且该周期中X元素原子核外未成对电子数最多,X应该是第四周期3d、4s能级半满的原子,为24号元素;该原子核外有24个电子,根据构造原理书写其基态原子的电子排布式;
(3)臭齅排放的臭气主要成分为3-MBT-甲基2丁烯硫醇,结构简式为![]() ),共价单键为σ键、共价双键中一个是σ键另一个是排键,所以1个3-MBT分子中含有15个σ键;存在分子间氢键的物质熔沸点较高;
),共价单键为σ键、共价双键中一个是σ键另一个是排键,所以1个3-MBT分子中含有15个σ键;存在分子间氢键的物质熔沸点较高;
(4)含有自由移动离子的化合物能导电;孤电子对对成键电子的排斥力大于成键电子对间的排斥力;该晶胞中PCl5个数=1+8×![]() =2,晶胞体积=(a×10-10cm)3,晶胞密度=
=2,晶胞体积=(a×10-10cm)3,晶胞密度=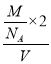 。
。
(1)F对最外层电子的吸引力比O强,N原子核外电子处于半满的较稳定状态,所以第一电离能均高于O元素
(2)元素X与(Se)同周期,且该周期中X元素原子核外未成对电子数最多,X应该是第四周期3d、4s能级半满的原子,为24号元素;该原子核外有24个电子,根据构造原理书写其基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1;
(3)臭齅排放的臭气主要成分为3-MBT-甲基2丁烯硫醇,结构简式为![]() ),共价单键为σ键、共价双键中一个是σ键另一个是Π键,所以1个3-MBT分子中含有15个σ键,则1mol该分子中含有15NA个σ键;(CH3)2C=CHCH2OH分子间含有氢键,增大分子间的作用力,使沸点升高;
),共价单键为σ键、共价双键中一个是σ键另一个是Π键,所以1个3-MBT分子中含有15个σ键,则1mol该分子中含有15NA个σ键;(CH3)2C=CHCH2OH分子间含有氢键,增大分子间的作用力,使沸点升高;
(4)含有自由移动离子的化合物能导电,PCl5是一种白色晶体,熔融时形成一种能导电的液体测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,阳离子、阴离子分别为PCl4+、PCl6-,其电离方程式为2PCl5 ![]() PCl4++PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以正四面体形阳离子中键角大于PCl3的键角;该晶胞中PCl5个数=1+8×
PCl4++PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以正四面体形阳离子中键角大于PCl3的键角;该晶胞中PCl5个数=1+8×![]() =2,晶胞体积=(a×10-10cm)3,晶胞密度=
=2,晶胞体积=(a×10-10cm)3,晶胞密度=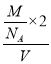 =
=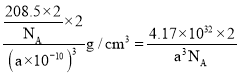 g/cm3。
g/cm3。


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol·L-1AlCl3溶液中含有的Al3+数目小于NA
B.标准状况下,11 g 3H216O中含有的质子数目为6NA
C.1 mol Li2O和Na2O2的混合物中含有的离子总数大于3NA
D.常温常压下,4.6 g NO2所含的氮原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数,下列说法正确的是
A.用氢氧燃料电池电解饱和食盐水得到 0.4mol NaOH,在燃料电池的负极上消耗氧气分子数为 0.1 NA
B.2 mol H3O+中含有的电子数为 20 NA
C.密闭容器中 1 mol N2(g)与 3 mol H2 (g)反应制备氨气,形成 6 NA 个 N-H 键
D.32 g N2H4中含有的共用电子对数为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
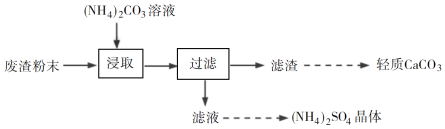
(1)室温下,反应CaSO4(s)+![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)达到平衡,则溶液中
(aq)达到平衡,则溶液中 =________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
=________[Ksp(CaSO4)=4.8×105,Ksp(CaCO3)=3×109]。
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为________;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是________。
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70 ℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是________;保持温度、反应时间、反应物和溶剂的量不变,实验中提高CaSO4转化率的操作有________。

(4)滤渣水洗后,经多步处理得到制备轻质CaCO3所需的CaCl2溶液。设计以水洗后的滤渣为原料,制取CaCl2溶液的实验方案:______[已知pH=5时Fe(OH)3和Al(OH)3沉淀完全;pH=8.5时Al(OH)3开始溶解。实验中必须使用的试剂:盐酸和Ca(OH)2]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.25℃时 pH=2 的 HF 溶液中,由水电离产生的 OH-浓度为 10-12 mol·L-1
B.0.1 mol·L-1 Na2CO3 溶液中:c(Na+)=c(HCO3 -)+c(H2CO3)+2c(CO32- )
C.向 1 L 1 mol·L-1 的 NaOH 热溶液中通入一定量 Br2,恰好完全反应生成溴化钠、次溴酸钠和溴酸钠(溴 酸为强酸、次溴酸为弱酸)的混合溶液:c(Na+)+c(H+)=6c(BrO3-)+2c(BrO-)+c(HBrO)+c(OH-)
D.25℃时 pH=3 的盐酸与 pH=11 的氨水等体积混合,所得溶液的 pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2·H2O也是一元弱碱,25℃时电离常Kb=4.0×10-5。现用0.0500mol/L的稀硫酸滴定10mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示。下列说法正确的是
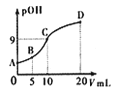
A. 甲胺在水中的电离方程式为:CH3NH2·H2O=CH3NH3++OH-
B. A、B、C三点溶液中,水电离出来的c(H+):B>C>A
C. C点所在溶液中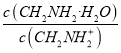 =2.5×10-5
=2.5×10-5
D. B点溶液中存在c(CH3NH2·H2O)>c(CH3NH3+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() CH=CH-CHO),杏仁含苯甲醛(
CH=CH-CHO),杏仁含苯甲醛(![]() CHO)。下列说法错误的是
CHO)。下列说法错误的是
A. 肉桂醛,苯甲醛都能发生加成反应、取代反应和聚合反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A. 向苦卤中通入Cl2是为了提取溴
B. 粗盐可采用除杂和重结晶等过程提纯
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,恒容密闭容器内发生反应:H2(g)+I2 (g) ![]() HI(g) Δ H< 0,该温度下, K=43。某时刻,测得容器内 H2、I2、HI 的浓度依次为 0.01 mol/L、0.01mol/L、0.02mol/L。 一段时间后,下列情况与事实相符的是
HI(g) Δ H< 0,该温度下, K=43。某时刻,测得容器内 H2、I2、HI 的浓度依次为 0.01 mol/L、0.01mol/L、0.02mol/L。 一段时间后,下列情况与事实相符的是
A.氢气的体积分数变小B.混合气体密度变大
C.混合气体颜色变深D.容器内压强变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com