
【题目】某同学进行胆矾结晶水测定实验,得到下(1)~(4)组数剧:
编号 | 加热前 | 加热后 | |
坩埚质量(克) | 坩埚+胆矾质量(克) | 坩埚+无水CuSO4质量(克) | |
(1) | 5.0 | 7.5 | 6.6 |
(2) | 5.42 | 7.95 | 6.8 |
(3) | 5.5 | 8.0 | 7.1 |
(4) | 5.0 | 7.5 | 6.8 |
实验数据表明有两次实验失误,失误的实验是( )
A.(1)和(2)
B.(2)和(4)
C.(1)和(3)
D.(3)和(4)
科目:高中化学 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
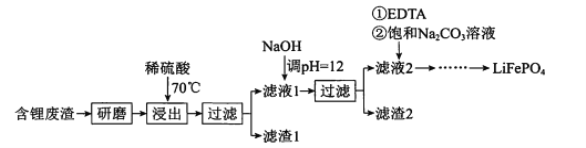
资料:ⅰ滤液1、滤液2中部分两者的浓度(g/L)

ⅱEDTA能和某些二价金属离子形成稳定的水溶性络合物。
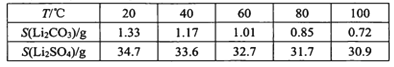
ⅲ某些物质溶解度(S):
I.制备Li2CO3粗品
(l)上述流程中为加快化学反应速率而采取的措施是 ___。
(2)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出 固体Li2CO3粗品的操作是 ______。
(3)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是 ____g。(摩尔质量:Li 7 g.mol-l Li2CO3 74 g.mol-l)
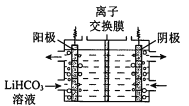
II.纯化Li2CO3粗品
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是 _______。
III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.电解池的阴极上发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子发生转移,则生成1 mol NaOH
D.酸溶液、碱溶液、盐溶液电解后,溶液的pH都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表共有18个纵行,从左到右排为1~18列,即碱金属是第一列,稀有气体是第18列。按这种规定,下面说法正确的是( )
A. 最外层电子数为ns2的元素都在第2列
B. 第5列元素的原子最外层电子的排布式为![]()
C. 第10、11列为ds区的元素
D. 形成化合物种类最多的元素在第14列,属于P区的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ·mol-1。现有H2与CH4的混合气体112L(标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3845.8kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1:1B.1:3C.1:4D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下:
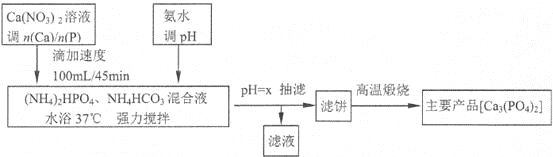
(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:

(1)流程中强调“滴加速度100mL/45min的作用是______________________________。流程中调pH选氨水,不选生石灰或石灰乳的理由是_____________________________。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为___,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和_____________。
(3)酸性条件下产率偏低的原因是________________________________________。
(4)“高温煅烧”滤饼,化学反应方程式为___________________________________。
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为______。
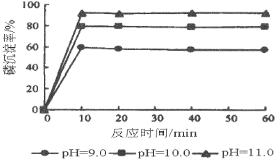
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法错误的是( )
3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法错误的是( )
A.0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ
B.Y的起始浓度不能为零,平衡浓度也不能为零
C.在其他条件不变的情况下,改变反应温度,平衡一定会发生移动
D.当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅根据题中图示得出的结论不合理的是![]()
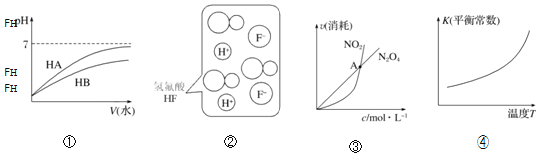
A.由①可知,HB为弱酸
B.由②可知,HF为弱电解质
C.由③可知,恒温恒容条件下的反应:![]() ,A点为平衡状态
,A点为平衡状态
D.由④可知,该反应的正反应:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com