
【题目】磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下:
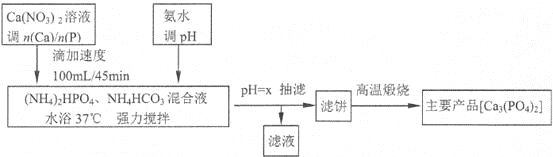
(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:

(1)流程中强调“滴加速度100mL/45min的作用是______________________________。流程中调pH选氨水,不选生石灰或石灰乳的理由是_____________________________。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为___,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和_____________。
(3)酸性条件下产率偏低的原因是________________________________________。
(4)“高温煅烧”滤饼,化学反应方程式为___________________________________。
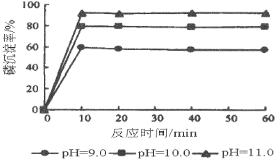
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为______。
【答案】使反应物充分接触 若选择生石灰或石灰乳调节pH会改变![]() 7.2 CaCO3 酸性条件下,容易造成钙的流失;(或“酸性条件下,容易造成钙磷流失
7.2 CaCO3 酸性条件下,容易造成钙的流失;(或“酸性条件下,容易造成钙磷流失
或酸性条件下,难溶产物易溶解转化为易溶物质造成钙磷流失或酸性条件下,Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4等易转化为可溶的Ca(H2PO4)2,造成钙磷流失) 2CaHPO4+CaCO3![]() Ca3(PO4)2+H2O+CO2↑或Ca5(PO4)3OH+CaHPO4
Ca3(PO4)2+H2O+CO2↑或Ca5(PO4)3OH+CaHPO4![]() 2Ca3(PO4)2+H2O 0.056mmolL-1min-1或5.6×10-5mol/(Lmin)
2Ca3(PO4)2+H2O 0.056mmolL-1min-1或5.6×10-5mol/(Lmin)
【解析】
(1)滴加速度较慢,可以使混合物充分接触;根据对![]() 的影响分析;
的影响分析;
(2)根据![]() 的值,及产率综合分析;根据反应物判断滤饼的化学成分;
的值,及产率综合分析;根据反应物判断滤饼的化学成分;
(3)酸性条件下易生成可溶性的Ca(H2PO4)2;
(4)高温下,CaHPO4与CaCO3反应生成Ca3(PO4)2;
(5)根据图可知pH=10.0条件下,磷的沉淀率为80%,根据v=![]() 计算。
计算。
(1)滴加速度较慢,可以使混合物充分接触,所以滴加速度100mL/45min的作用是使反应物充分接触;流程中调pH选氨水,不选生石灰或石灰乳,是因为生石灰或石灰乳能增大钙离子的浓度,会改变![]() ;
;
故答案为:使反应物充分接触;若选择生石灰或石灰乳调节PH会改变![]() ;
;
(2)当PH=7.2,![]() =1.5时,Ca与P恰好为3:2,符合Ca3(PO4)2中Ca与P的比例,此时产率较高,所以选择PH=7.2;已知反应物为(NH4)2HPO4、NH4HCO3、Ca(NO3)2,所以滤饼的化学成分为Ca5(PO4)3OH、Ca3(PO4)2、CaHPO4和CaCO3;
=1.5时,Ca与P恰好为3:2,符合Ca3(PO4)2中Ca与P的比例,此时产率较高,所以选择PH=7.2;已知反应物为(NH4)2HPO4、NH4HCO3、Ca(NO3)2,所以滤饼的化学成分为Ca5(PO4)3OH、Ca3(PO4)2、CaHPO4和CaCO3;
故答案为:7.2;CaCO3;
(3)酸性条件下易生成可溶性的Ca(H2PO4)2,造成钙、磷的流失;
故答案为:酸性条件下,容易造成钙的流失;
(4)高温下,CaHPO4与CaCO3反应生成Ca3(PO4)2,其反应的方程式为:2CaHPO4+CaCO3=Ca3(PO4)2+CO2↑+H2O;
故答案为:2CaHPO4+CaCO3= Ca3(PO4)2+CO2↑+H2O;
(5)根据图可知pH=10.0条件下,磷的沉淀率为80%,磷的初始浓度为0.70mmol/L,则反应的量为0.70mmol/L×80%=0.56mmol/L,则v=![]() =
=![]() =0.056mmol/(Lmin);
=0.056mmol/(Lmin);
故答案为:0.056mmol/(Lmin)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。
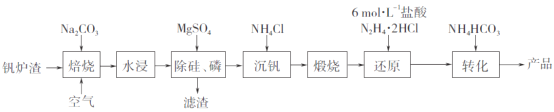
(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参照反应Br + H2 →HBr +H的能量对反应历程的示意图,下列叙述中正确的是( )
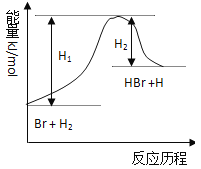
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热不改变
C.加入催化剂,该化学反应的活化能不改变
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 ph=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②可用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤⑤ 的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行胆矾结晶水测定实验,得到下(1)~(4)组数剧:
编号 | 加热前 | 加热后 | |
坩埚质量(克) | 坩埚+胆矾质量(克) | 坩埚+无水CuSO4质量(克) | |
(1) | 5.0 | 7.5 | 6.6 |
(2) | 5.42 | 7.95 | 6.8 |
(3) | 5.5 | 8.0 | 7.1 |
(4) | 5.0 | 7.5 | 6.8 |
实验数据表明有两次实验失误,失误的实验是( )
A.(1)和(2)
B.(2)和(4)
C.(1)和(3)
D.(3)和(4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为MnO2+SO2MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液pH范围为____。
(3)下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为____。

(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中,加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,写出该反应的热化学方程式_____________________________;

(2)已知该反应中相关的化学键键能数据如图所示,则C≡O中的键能为_____kJmol﹣1;图中曲线Ⅱ表示____________(填反应条件)的能量变化。
化学键 | H﹣H | C﹣O | H﹣O | C﹣H |
E/(kJmol﹣1) | 436 | 343 | 465 | 413 |
(3)图中数字“419”表示的是_________________________;
(4)下列反应中,属于放热反应的是_______ (填编号,下同),属于吸热反应的是_______;
①物质燃烧;②炸药爆炸;③酸碱中和反应;④二氧化碳通过炽热的碳;⑤食物因氧化而腐败;⑥Ba(OH)28H2O与NH4Cl反应;⑦铁粉与稀盐酸反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
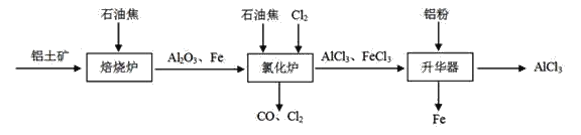
(1)焙烧炉中发生反应:①Fe2O3(s)+3C(s)![]() 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K=_____。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为_____;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为____。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为_____。
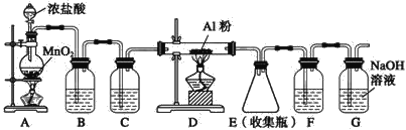
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为_____、_____,F中所盛放试剂的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,下列叙述正确的是
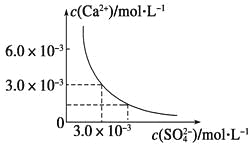
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com