
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,下列叙述正确的是
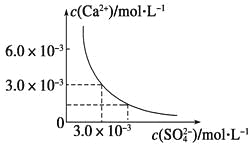
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
【答案】D
【解析】
由图知,Ksp(CaSO4)=c(Ca2+)·c(SO42-)=3.0×10-3×3.0×10-3=9×10-6,在CaSO4饱和溶液中c(Ca2+)=c(SO42-)=3.0×10-3 mol·L-1。加入400 mL 0.01 mol·L-1 Na2SO4溶液后,c(Ca2+)=6×10-4(mol·L-1),=8.6×10-3(mol·L-1),Qc=c(Ca2+)·c(SO42-)=6×10-4×8.6×10-3=5.16×10-6<Ksp,所以没有(CaSO4沉淀析出,但溶液中c(SO42-)变大了,c(Ca2+)变小了,故只有D项正确,
答案选D。


科目:高中化学 来源: 题型:
【题目】磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下:
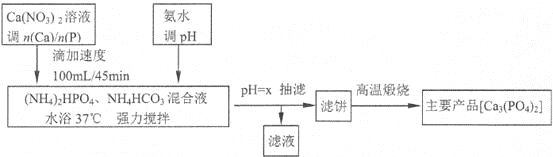
(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:

(1)流程中强调“滴加速度100mL/45min的作用是______________________________。流程中调pH选氨水,不选生石灰或石灰乳的理由是_____________________________。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为___,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和_____________。
(3)酸性条件下产率偏低的原因是________________________________________。
(4)“高温煅烧”滤饼,化学反应方程式为___________________________________。
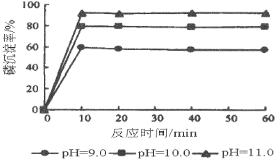
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是( )

A.甲胺在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH—
CH3NH3++OH—
B.b点对应的加入盐酸的体积小于20mL
C.a点对应的溶液中c(CH3NH2)< c(CH3NH3+)
D.常温下,甲胺的电离常数为Kb,则pKb=—lgKb=3.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时间内生成n mo1 O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②④⑤ C.①③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅根据题中图示得出的结论不合理的是![]()
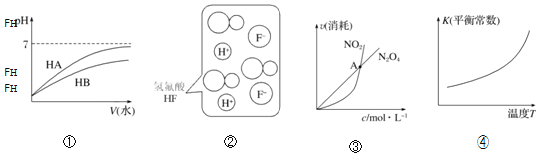
A.由①可知,HB为弱酸
B.由②可知,HF为弱电解质
C.由③可知,恒温恒容条件下的反应:![]() ,A点为平衡状态
,A点为平衡状态
D.由④可知,该反应的正反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.![]() 时,将
时,将![]() 的碳酸钠溶液加水稀释100倍,所得溶液的
的碳酸钠溶液加水稀释100倍,所得溶液的![]()
B.pH相同的盐酸和醋酸溶液分别与足量镁粉反应,醋酸产生![]() 体积更大
体积更大
C.![]() 时,
时,![]() 的HA弱酸溶液与
的HA弱酸溶液与![]() 的NaOH溶液等体积混合,所得溶液pH一定小于7
的NaOH溶液等体积混合,所得溶液pH一定小于7
D.![]() 溶液中加入一定量
溶液中加入一定量![]() 晶体,溶液中
晶体,溶液中![]() 增大,可以证明
增大,可以证明![]() 为弱酸
为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,著名记者柴静的雾霾调查纪录片![]() 穹顶之下
穹顶之下![]() ,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.
,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.

(1)上述流程中循环使用的物质有 ______ ,吸收池Ⅰ吸收的气体有 ______ .
(2)向吸收池Ⅳ得到的![]() 溶液中滴加
溶液中滴加![]() 溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: ______ .
溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: ______ .
(3)电解池Ⅴ制得![]() 的原理如图1所示.
的原理如图1所示.
写出电解总反应的离子方程式 ______ .

(4)![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() ,反应过程中的能量变化如图2,
,反应过程中的能量变化如图2,![]() ,
,![]() .
.
已知:①![]()
②![]()
请写出NO与CO反应生成无污染气体的热化学方程式: ______ .
(5)上述流程中每一步均恰好完全反应,若制得![]() 质量为xkg,电解池V制得
质量为xkg,电解池V制得![]() 的
的![]() 溶液
溶液![]() ,则氧化池Ⅵ中消耗的
,则氧化池Ⅵ中消耗的![]() 在标准状况下的体积为 ______
在标准状况下的体积为 ______ ![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应:
3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2min,D的平均反应速率为0.2mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增加B,平衡向右移动,B的平衡转化率增大
D. 增大该体系的压强,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com