
【题目】常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是( )

A.甲胺在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH—
CH3NH3++OH—
B.b点对应的加入盐酸的体积小于20mL
C.a点对应的溶液中c(CH3NH2)< c(CH3NH3+)
D.常温下,甲胺的电离常数为Kb,则pKb=—lgKb=3.4
【答案】C
【解析】
A、甲胺(CH3NH2)类似于氨,但碱性稍强于氨,说明甲胺是一元弱碱,在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH-,选项A正确;
CH3NH3++OH-,选项A正确;
B、若加入20mL的盐酸,则盐酸和甲胺恰好完全反应生成CH3NH3Cl溶液,CH3NH3Cl是强酸弱碱盐,所得溶液呈酸性,b点溶液呈中性,所以b点对应加入盐酸的体积小于20mL,选项B正确;
C、a点lg =0,
=0,![]() =
=![]() ,选项C不正确;
,选项C不正确;
D、由甲胺的电离方程式CH3NH2+H2O![]() CH3NH3++OH-可知,甲胺的电离常数为Kb=
CH3NH3++OH-可知,甲胺的电离常数为Kb=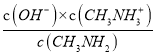 ,a点溶液的pH=10.6,c(OH-)=10-3.4,lg
,a点溶液的pH=10.6,c(OH-)=10-3.4,lg =0,则pKb=-lgKb=-lg
=0,则pKb=-lgKb=-lg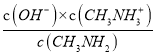 =-lgc(OH-)-lg
=-lgc(OH-)-lg =- lgc(OH-)=3.4,选项D正确;
=- lgc(OH-)=3.4,选项D正确;
答案选C。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】参照反应Br + H2 →HBr +H的能量对反应历程的示意图,下列叙述中正确的是( )
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热不改变
C.加入催化剂,该化学反应的活化能不改变
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,写出该反应的热化学方程式_____________________________;

(2)已知该反应中相关的化学键键能数据如图所示,则C≡O中的键能为_____kJmol﹣1;图中曲线Ⅱ表示____________(填反应条件)的能量变化。
化学键 | H﹣H | C﹣O | H﹣O | C﹣H |
E/(kJmol﹣1) | 436 | 343 | 465 | 413 |
(3)图中数字“419”表示的是_________________________;
(4)下列反应中,属于放热反应的是_______ (填编号,下同),属于吸热反应的是_______;
①物质燃烧;②炸药爆炸;③酸碱中和反应;④二氧化碳通过炽热的碳;⑤食物因氧化而腐败;⑥Ba(OH)28H2O与NH4Cl反应;⑦铁粉与稀盐酸反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
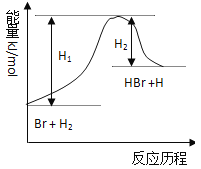
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
(1)焙烧炉中发生反应:①Fe2O3(s)+3C(s)![]() 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K=_____。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为_____;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为____。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为_____。
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为_____、_____,F中所盛放试剂的作用是_____。
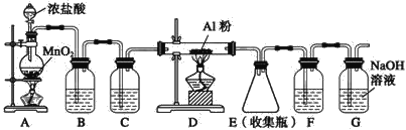
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子构型为3s23p4的粒子描述正确的是( )
A.它的原子核外有三种形状不同的电子云
B.它的原子核外电子共有16种不同的运动状态
C.它可与H2反应生成的化合物为非极性分子
D.核外电子轨道表示式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
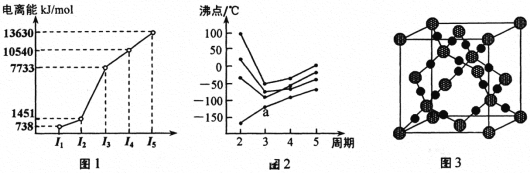
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
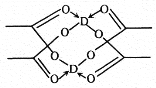
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。

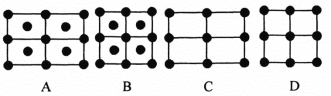
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯可在金属锡、盐酸作用下生成氯化苯铵盐(![]() )、氯化亚锡(SnCl2)和水。
)、氯化亚锡(SnCl2)和水。
(1)写出Sn2+的最外层电子排布式___________;Cl-中有_________个填充电子的能级。
(2)画出硝基的电子式____________,氯化亚锡分子的空间构型是________________;氯化苯胺盐(![]() )中N原子的杂化方式为_______________,该盐的水溶度较苯胺大的原因是____________________________________________________。
)中N原子的杂化方式为_______________,该盐的水溶度较苯胺大的原因是____________________________________________________。
(3)Sn的一种同素异形体——灰锡的晶体结构类似金刚石,立方晶胞结构如图所示,则锡的配位数是_______。

(4)假设锡原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,计算灰锡的空间利用率约为________________。(百分数表示,取两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,下列叙述正确的是
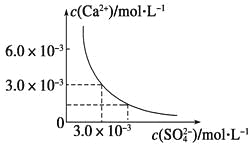
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰基扁桃酰氯是一种医药中间体。 某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。

已知:

(1)甲苯与氯气反应生成 A的条件是________。
(2)物质 B中含有的官能团是________。
(3)物质 D 的结构简式是_________。
(4)下列说法正确的是________。
a.化合物 A不能发生取代反应
b.乙酰基扁桃酰氯属于芳香烃
c.化合物 C 能与新制的 Cu(OH)2发生反应
(5)E+F→G 的化学方程式是_______。
(6)化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有_______ 种,写出其中两种的同分异构体的结构简式_______。
①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR 谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(7)设计以乙醇为原料制备 F 的合成路线(用流程图表示;无机试剂任选) _______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com