
【题目】参照反应Br + H2 →HBr +H的能量对反应历程的示意图,下列叙述中正确的是( )
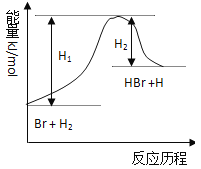
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热不改变
C.加入催化剂,该化学反应的活化能不改变
D.加入催化剂可增大正反应速率,降低逆反应速率
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:
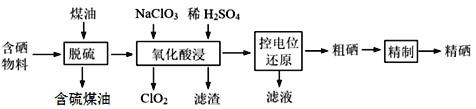
回答下列问题:
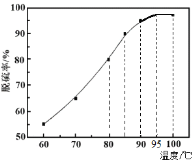
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。
(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为_____________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。
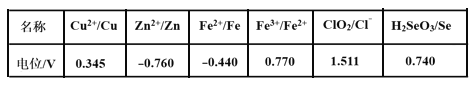
①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(S2-)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为________ %,与粗硒中铁含量为0.89%相比,铁含量明显降低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
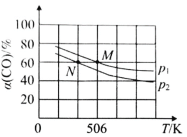
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
A.容器内压强保持不变 B.2v正
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。回答下列问题:
3Na2S2O3+CO2。回答下列问题:

(1)装置A的作用是制备______________,反应的化学方程式为______________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): ① |
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出, ② ⅱ.pH计读数逐渐 ③ | 反应分步进行: Na2CO3+SO2 2Na2S+3SO2 Na2SO3+S |
当pH计读数接近7时,立即停止通SO2,操作是 ④ | 必须立即停止通SO2的原因是: ⑤ |
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.电解池的阴极上发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子发生转移,则生成1 mol NaOH
D.酸溶液、碱溶液、盐溶液电解后,溶液的pH都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有主族元素X、Y、Z,X原子的最外层电子排布式为![]() ,Y原子M能层的p能级上有4个电子,Z原子的最外层p能级上也有4个电子,且Z原子的核外电子比Y原子少8个。由这三种元素组成的化合物不可能是
,Y原子M能层的p能级上有4个电子,Z原子的最外层p能级上也有4个电子,且Z原子的核外电子比Y原子少8个。由这三种元素组成的化合物不可能是![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表共有18个纵行,从左到右排为1~18列,即碱金属是第一列,稀有气体是第18列。按这种规定,下面说法正确的是( )
A. 最外层电子数为ns2的元素都在第2列
B. 第5列元素的原子最外层电子的排布式为![]()
C. 第10、11列为ds区的元素
D. 形成化合物种类最多的元素在第14列,属于P区的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下:
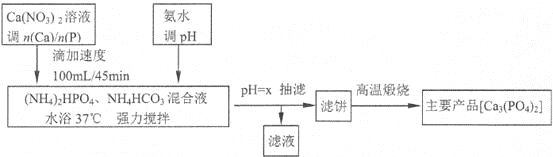
(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:

(1)流程中强调“滴加速度100mL/45min的作用是______________________________。流程中调pH选氨水,不选生石灰或石灰乳的理由是_____________________________。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为___,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和_____________。
(3)酸性条件下产率偏低的原因是________________________________________。
(4)“高温煅烧”滤饼,化学反应方程式为___________________________________。
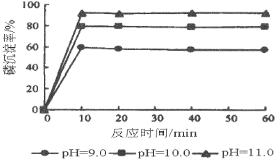
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是( )

A.甲胺在水中的电离方程式CH3NH2+H2O![]() CH3NH3++OH—
CH3NH3++OH—
B.b点对应的加入盐酸的体积小于20mL
C.a点对应的溶液中c(CH3NH2)< c(CH3NH3+)
D.常温下,甲胺的电离常数为Kb,则pKb=—lgKb=3.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com