
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为MnO2+SO2MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液pH范围为____。
(3)下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为____。

(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中,加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)_____。
【答案】4.48 5.0<pH<7.1 高于60℃ 根据氧化还原反应中得失电子守恒: n(Mn3+)×1=n(Fe2+)×1=20.00×10-3L×0.050 0 mol·L-1=1.00×10-3mol,根据锰元素守恒,m(MnSO4·H2O)=1.00×10-3mol×169 g·mol-1=0.169g,样品的纯度是![]() ×100%≈98.8%
×100%≈98.8%
【解析】
(1)根据MnO2+SO2=MnSO4可知,n(SO2)=n(MnO2);
(2)pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+,结合Al(OH)3完全变成沉淀时的pH、Fe(OH)3完全变成沉淀时的pH分析;
(3)从MnSO4和MgSO4混合溶液中结晶MnSO4H2O晶体,根据图上信息,高于60℃以后MnSO4H2O的溶解度减小,而MgSO46H2O的溶解度增大,因此控制结晶温度范围是高于60℃;
(4)根据氧化还原反应中得失电子守恒:n(Mn3+)×1=n(Fe2+)×1=0.02L×0.0500mol=1.00×10-3mol,根据Mn元素守恒,m(MnSO4H2O)=1.00×10-3mol×169g/mol=0.169g,以此计算纯度。
(1)根据反应方程式,n(SO2)=n(MnO2)= ![]() mol=0.2mol,因此V(SO2)=0.2×22.4L=4.48L;
mol=0.2mol,因此V(SO2)=0.2×22.4L=4.48L;
(2)制备MnSO4,再根据信息,pH小于7.1,氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6mol·L-1,得出:c(OH-)=1×10-9mol·L-1,c(H+)=Kw/c(OH-)=10-5,pH=5,同理计算出Fe(OH)3完全变成沉淀时,pH约为3.5,故范围是:5.0<pH<7.1;
(3)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,根据图上信息,高于60℃以后MnSO4·H2O的溶解度减小,而MgSO4·6H2O的溶解度增大,因此控制结晶温度范围是高于60℃,这样可以得到纯净的MnSO4·H2O;
(4)根据氧化还原反应中得失电子守恒:n(Mn3+)×1=n(Fe2+)×1=20.00×10-3×0.0500mol=1.00×10-3mol,根据Mn元素守恒,m(MnSO4·H2O)=1.00×10-3×169g=0.169g,纯度是:![]() ×100%=98.8%。
×100%=98.8%。


科目:高中化学 来源: 题型:
【题目】研究![]() 、
、![]() 、
、![]() 等的处理方法对环境保护有重要意义。
等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成![]() 和
和![]() ,其反应为:
,其反应为:![]()
![]()
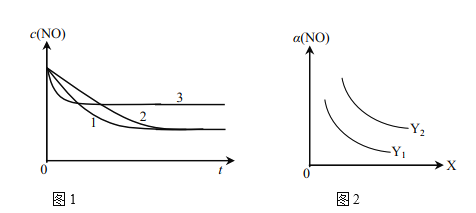
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是________。(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验温度NO初始浓度O初始浓度催化剂比表面积催化剂用量编号(℃)
实验 编号 | 温度 (℃) | NO初始浓度
| CO初始浓度
| 催化剂比表面积
| 催化剂用量 (g) |
Ⅰ | 280 |
|
| 82 | 50 |
Ⅱ | 280 |
|
| 124 | 50 |
Ⅲ | 350 |
|
| 124 | 50 |
②图2表示NO的平衡转化率(a)随温度、压强变化的示意图。X表示的是________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应
以体积比1:2置于密闭容器中发生反应![]() ,达到平衡时
,达到平衡时![]() 的体积分数为25%。该反应的平衡常数
的体积分数为25%。该反应的平衡常数![]() ________。
________。
(3)利用原电池反应可实现![]() 的无害化,总反应为
的无害化,总反应为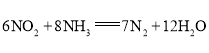 ,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有主族元素X、Y、Z,X原子的最外层电子排布式为![]() ,Y原子M能层的p能级上有4个电子,Z原子的最外层p能级上也有4个电子,且Z原子的核外电子比Y原子少8个。由这三种元素组成的化合物不可能是
,Y原子M能层的p能级上有4个电子,Z原子的最外层p能级上也有4个电子,且Z原子的核外电子比Y原子少8个。由这三种元素组成的化合物不可能是![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.2017年5月5日,中国首架按照国际标准研制的拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成CO2和N2的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<0。
N2(g)+2CO2(g)△H<0。
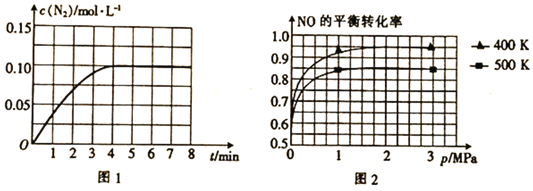
(1)若将1mol NO和2mol CO通入2L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=__________,4min末CO的浓度为__________mol·L-1。
(2)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置中比较适合的温度和压强是__________
II.取50 mL0.50mol·L-1NaOH溶液和50 mL、0.50mol/L硫酸溶液进行中和热测定实验,实验数据如下表:
(1)请填写表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 31.4 | |
(2)近似认为0.50mol·L-1 NaOH 溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c =4.18J·g-1·℃-1。则中和热△H=__________。(取小数点后一位)
(3)上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是__________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下:
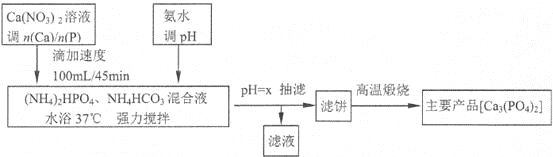
(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:

(1)流程中强调“滴加速度100mL/45min的作用是______________________________。流程中调pH选氨水,不选生石灰或石灰乳的理由是_____________________________。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为___,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和_____________。
(3)酸性条件下产率偏低的原因是________________________________________。
(4)“高温煅烧”滤饼,化学反应方程式为___________________________________。
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为______。
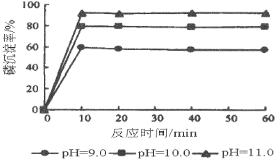
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
A. 容器的温度保持不变 B. 容器的压强保持不变
C. υ正(N2)=6υ逆(HCl) D. 容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.![]() 时,将
时,将![]() 的碳酸钠溶液加水稀释100倍,所得溶液的
的碳酸钠溶液加水稀释100倍,所得溶液的![]()
B.pH相同的盐酸和醋酸溶液分别与足量镁粉反应,醋酸产生![]() 体积更大
体积更大
C.![]() 时,
时,![]() 的HA弱酸溶液与
的HA弱酸溶液与![]() 的NaOH溶液等体积混合,所得溶液pH一定小于7
的NaOH溶液等体积混合,所得溶液pH一定小于7
D.![]() 溶液中加入一定量
溶液中加入一定量![]() 晶体,溶液中
晶体,溶液中![]() 增大,可以证明
增大,可以证明![]() 为弱酸
为弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com