
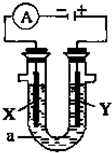
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
| ||
| ||


科目:高中化学 来源: 题型:
 如图表示的物质或概念间的从属关系中不正确的是( )
如图表示的物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 置换反应 | 氧化还原反应 | 离子反应 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强/MPa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 次数 | 镁带质量 (g) | 硫酸体积 (mL) | C瓶中液体体积(mL) | 抽出气体的体积 (mL) | 氢气体积 (mL) | 计算1mol氢气体积(L) 两次实验的平均值(保留一位小数) |
| 1 | 0.120 | 10.0 | 119.3 | 8.0 | ||
| 2 | 0.112 | 10.0 | 115.7 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com