

| ||
| ||
| n |
| V |
| 0.08mol |
| 0.1L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
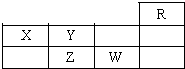
| A、常压下五种元素的单质中W单质的沸点最高 |
| B、Z的氢化物比Y的氢化物稳定 |
| C、W元素最高价氧化物的水化物酸性比Z元素的强 |
| D、Z、W的阴离子电子层结构与R原子的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,写出由G生成I的化学反应方程式
,写出由G生成I的化学反应方程式查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热能杀死H1N1流感病毒是因为病毒蛋白质受热变性 |
| B、不锈钢是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| C、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| D、加碘食盐中主要添加的是碘化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com