
| 8.96L |
| 22.4L/mol |
| 19.2g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、与H2化合时X单质比Y单质容易 |
| B、X的最高价氧化物的水化物的碱性比Y的最高价氧化物的水化物的碱性强 |
| C、X原子的最外层电子数比Y原子的最外层电子数多 |
| D、X单质不可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离的c(OH-)=1×10-12mol/L的溶液中:Ba2+、K+、Br-、SiO32-一定能大量共存 |
| B、向氯化铝溶液中加入过量的氨水离子方程式是:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| C、1.0L 0.3mol?L-1 NaOH溶液缓慢通入CO2气体至溶液增重8.8g,所得溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
| D、0.1mol?L-1 CH3COONa溶液中:c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| B、温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变 |
| C、8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
| D、由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
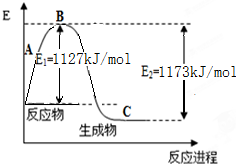 氨气是一种重要的化工原料,工业上用N2和H2合成NH3.现已知N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图如图.回答下列问题:
氨气是一种重要的化工原料,工业上用N2和H2合成NH3.现已知N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图如图.回答下列问题:| 化学键 | H-H | N≡N |
| 键能(kJ、mol) | 436 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com