
����Ŀ��ij����ɱ���ܱ�������ʢ��������A��B�Ļ�����壬��һ�������·�����Ӧ��A��3B![]() 2C����ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ���������ΪV L������C��������ռ10%�������ƶ���ȷ����(����)
2C����ά���¶Ⱥ�ѹǿ���䣬���ﵽƽ��ʱ���������ΪV L������C��������ռ10%�������ƶ���ȷ����(����)
��ԭ�����������Ϊ1.2V L����ԭ�����������Ϊ1.1V L���۷�Ӧ�ﵽƽ��ʱ����A���ĵ�0.05V L�ܷ�Ӧ�ﵽƽ��ʱ����B���ĵ�0.05V L
A. �ڢ� B. �ڢ� C. �٢� D. �٢�
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.���ײ��������Ҵ�B.С�մ������θ�����֢
C.�ɱ��������˹�����D.�辧������뵼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH4(g)+2O2(g)==CO2(g)+2H2O(1) ��H = �DQ1 kJ/mol
2H2(g)+O2(g)==2H2O(g) ��H = �DQ2 kJ/mol
2H2(g)+O2(g)==2H2O(1) ��H = �DQ3kJ/mol
�����£�ȡ�����Ϊ4:1�ļ���������Ļ������11.2L���ۺϳɱ�״����������ȫȼ�պ�ָ������£���ų�������Ϊ����kJ
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2
C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��25����101 kPa�£�1 g�״�ȼ������CO2��Һ̬ˮʱ����22.68 kJ����÷�Ӧ��ȼ���ȵ��Ȼ�ѧ����ʽӦΪ_________________��
(2)��ѧ��Ӧ���ʱ��뷴Ӧ���������ļ����йء���ν���ܾ��ǣ���101kPa��298 Kʱ���Ͽ�1 mol��̬ABΪ��̬A����̬Bʱ���̵��ʱ䣬����H298(AB)��ʾ���Ͽ���ѧ��ʱ��H��0����H2(g)=2H(g) ��H= +436 kJ��mol-1�ݣ��γɻ�ѧ��ʱ��H��0[��2H(g)=H2(g) ��H= - 436 kJ��mol-1]��
��֪��H2(g)+Cl2(g)=2HCl(g) ��H= -185 kJ��mol-1 ��H298��H2��=+ 436 kJ��mol-1 ,��H298��Cl2��= +247 kJ��mol-1����H298��HCl��=__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ��NO+CO2![]() NO2+CO���ܱ������н��У�������Щ�����ӿ�÷�Ӧ����
NO2+CO���ܱ������н��У�������Щ�����ӿ�÷�Ӧ����
A. �������ʹѹǿ��С B. ����������CO2ʹѹǿ����
C. ����������He��ʹѹǿ���� D. ѹǿ�������N2ʹ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֵ��ָһ�������µ�λ������������ȫȼ�����ų�����������֪H2(g)��CO(g)��CH3OH(l)����ֵ�ֱ�Ϊ143 kJ�� g��1��10 kJ��g��1��23 kJ��g��1����ش��������⣺
(1)д��COȼ�շ�Ӧ���Ȼ�ѧ����ʽΪ__________________________________________��
(2)��ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ__________________________________________��
(3)�״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ__________________________��
(4)���������ɷ������·�Ӧ��P4��g��+5O2(g)![]() P4O10(g)����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��P��P a kJ/mol��P��O b kJ/mol��P=O c kJ/mol��O=O d kJ/mol����ͼʾ�ķ��ӽṹ���й����ݼ���÷�Ӧ�ķ�Ӧ��_____________��
P4O10(g)����֪�������л�ѧ����Ҫ���յ������ֱ�Ϊ��P��P a kJ/mol��P��O b kJ/mol��P=O c kJ/mol��O=O d kJ/mol����ͼʾ�ķ��ӽṹ���й����ݼ���÷�Ӧ�ķ�Ӧ��_____________��
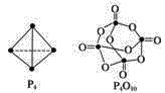
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO�� �� H��
CH3COO�� �� H��
(1)ij�¶�ʱ��0.1 mol��L��1�Ĵ�����Һ�е�c(H��) ��0.01 mol��L��1�Ĵ�����Һ�е�c(H��)�ı�ֵ______(����ڡ���С�ڡ����ڡ�)10��
(2)��֪��25 ��ʱ���õ���ƽ���ƽ�ⳣ��Ϊ1.75��10��5��
������¶�ʱ��a mol��L��1�Ĵ�����Һ��c1(H��)��________________mol��L��1 (�ú�a�Ĵ���ʽ��ʾ)��[��ʾ����ʱ����ȱȽ�С�����м��㣬ƽ��ʱc(CH3COOH)���ó�ʼŨ�ȴ��棬ˮ�������c(H��)��c(OH��)���Բ��ƣ���ͬ]
�������¶�ʱ�����Һ�м���һ������CH3COONH4(������Һ�������)��ʹ��Һ��c(CH3COO��)Ϊb mol��L��1�����ʱc2(H��)��____________________mol��L��1(�ú�a��b�Ĵ���ʽ��ʾ)��
��c1(H��)________(����ڡ���С�ڡ����ڡ�)c2(H��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪT1ʱ��������X������Y��1.6mol����10L�����ܱ������У�������ӦX(g)+Y(g)![]() 2Z(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������������˵����ȷ����
2Z(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������������˵����ȷ����
t/min | 2 | 4 | 7 | 9 |
n��Y��/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. ��Ӧ0��4 min��ƽ�����ʦ�(Z)=0.25 mol/(Lmin)
B. T1ʱ����Ӧ��ƽ�ⳣ��K1��1.2
C. �����������䣬9 min�����������ٳ���1.6 molX��ƽ��������Ӧ�����ƶ����ٴδﵽƽ��ʱX��Ũ�ȼ�С��Y��ת��������
D. �����������䣬���µ�T2�ﵽƽ��ʱ��ƽ�ⳣ��K2=4����˷�Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NiSO4��6H2O��һ����ɫ������ˮ�ľ��壬�㷺���ڻ�ѧ������������صȡ����ɵ�Ʒ���(�������⣬������Cu��Zn��Fe��Cr������)Ϊԭ�ϻ�á�������������ͼ��
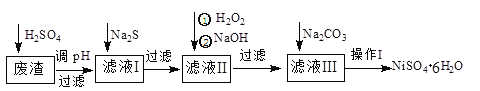
��ش��������⣺
(1)��ϡ�����ܽ����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��_________________(��дһ��)��
(2)����Һ�е���������Na2S��Һ��Ŀ���dz�ȥCu2+��Zn2+��д����ȥCu2+�����ӷ���ʽ��____________________________________________��
(3)��40�����ң���6%��H2O2����Fe2+������95��ʱ����NaOH����pH����ȥ���������⣬������NaClO3�����������ڽ�С��pH������ˮ�⣬��������һ��dz��ɫ�Ļ�������[Na2Fe6(SO4)4(OH)12]������ȥ����ͼ���¶ȡ�pH�����ɵij�����ϵͼ��ͼ����Ӱ�����ǻ������ȶ����ڵ�����[��֪25��ʱ��Fe(OH)3��Ksp=2.64��10��39]��
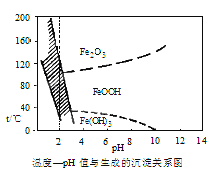
����˵����ȷ����(ѡ�����)_______��
a. FeOOH����Ϊ+2��
b.����25��ʱ����H2O2����Fe2+������pH=4ʱ��ȥ������ʱ��Һ��c(Fe3+)=2.6��10��29mol��L��1
c.������������������������Fe2+�����ӷ���ʽΪ6Fe2++C1O3��+6H+=6Fe3++C1��+3H2O
d.��ҵ�����г�������85~95�����ɻ������ƣ���ʱˮ���pHԼΪ3
(4)������������ҺI����Ҫ�ɷ���___________��
(5)����I��ʵ�鲽������Ϊ(ʵ���п�ѡ�õ��Լ���6mol��L��1��H2SO4��Һ������ˮ��pH��ֽ)��
��___________����___________��������Ũ������ȴ�ᾧ�����˵�NiSO4��6H2O���壺���������Ҵ�ϴ��NiSO4��6H2O���岢���ɡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com