
【题目】(1)A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
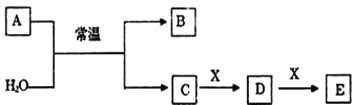
①若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___________________。
②若A为淡黄色粉末,X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种稀溶液,可选择的试剂为_________(填代号)。
a.盐酸 b.BaCl2溶液 c.Ca(OH)2溶液
③若A为非金属氧化物,B为气体,遇空气会变红棕色,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式________________。
(2)含碘化合物在生产、生活中都有重要用途,如碘化钠在医疗及食品方面有重要的作用,实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。水合肼(具有还原性)的制备有关反应原理为: CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。B、D中装分别装的试剂是____________
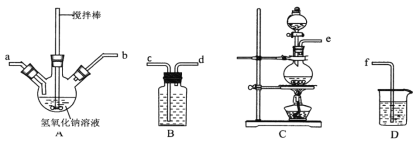
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5∶1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
【答案】OH-+HSO3-=SO32-+H2O ab 3NO2+H2O=2HNO3+NO ecdabf 饱和食盐水、氢氧化钠溶液 5∶3 NaClO溶液 尿素溶液
【解析】
(1)①若A为常见的金属单质,焰色反应呈黄色,应为Na,X能使品红溶液褪色,应为SO2,则B为H2,C为NaOH,D为Na2SO3,E为NaHSO3,据此分析解答;
②若A为淡黄色粉末,能够与水反应,则A为Na2O2,X为一种造成温室效应的气体,应为CO2,则B为氧气,C为NaOH,D为Na2CO3,E为NaHCO3,据此分析解答;
③若A为非金属氧化物,A与水反应生成的B为气体,遇空气会变红棕色,则A为NO2,B为NO,C为HNO3,X是Fe,则D为硝酸铁,E为硝酸亚铁,据此分析解答;
(2)①根据制备氯气、除杂、制备次氯酸钠和氧氧化钠、处理尾气的顺序分析;三颈瓶内ClO-与ClO3-的物质的量之比为5∶1,设ClO-与ClO3-的物质的量分别为5mol、1mol,根据得失电子守恒,生成6molClO-则会生成Cl-6mol,生成1mol ClO3--则会生成Cl-5mol,据此分析解答;
②NaClO具有强氧化性,水合肼具有还原性,据此分析解答。
(1)①若A为常见的金属单质,焰色反应呈黄色,应为Na,X能使品红溶液褪色,应为SO2,则B为H2,C为NaOH,D为Na2SO3,E为NaHSO3,C和E反应的离子方程式为OH-+HSO3-=SO32-+H2O,故答案为:OH-+HSO3-=SO32-+H2O;
②若A为淡黄色粉末,能够与水反应,则A为Na2O2,X为一种造成温室效应的气体,应为CO2,则B为氧气,C为NaOH,D为Na2CO3,E为NaHCO3,鉴别等浓度的D、E两种溶液,可用盐酸或氯化钡溶液,碳酸氢钠与盐酸反应放出二氧化碳的速度快;碳酸钠与氯化钡反应生成白色沉淀,故答案为:ab;
③若A为非金属氧化物,A与水反应生成的B为气体,遇空气会变红棕色,则A为NO2,B为NO,C为HNO3,X是Fe,则D为硝酸铁,E为硝酸亚铁,因此NO2与水反应的方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(2)①装置c由二氧化锰和浓盐酸制备氯气,用B装置的饱和食盐水除去HCl气体,导气管应该长进短出,氯气与NaOH在A中反应得到次氯酸钠,并和尿素反应制备水合肼,为充分反应,从a进去,由D装置中的氢氧化钠吸收未反应的氯气,防止污染空气,故导气管连接顺序为:ecdabf;三颈瓶内ClO-与ClO3-的物质的量之比为5∶1,设ClO-与ClO3-的物质的量分别为5mol、1mol,根据得失电子守恒,生成5molClO-则会生成Cl-5mol,生成1mol ClO3-则会生成Cl-5mol,则被还原的氯元素为化合价降低的氯元素,即为Cl-,有5mol+5mol=10mol,被氧化的氯元素为化合价升高的氯元素,ClO-与ClO3-共5mol+1mol=6mol,故被还原的氯元素与被氧化的氯元素的物质的量之比为10∶6=5∶3;故答案为:ecdabf;饱和食盐水、氢氧化钠溶液;5∶3;
②NaClO具有强氧化性,水合肼具有还原性,将尿素滴到NaClO溶液中或过快滴加,都会使过量的NaClO溶液氧化水合肼,降低产率,故实验中取适量A中的混合液逐滴加入到一定量的尿素溶液中制备水合肼,滴加顺序不能颠倒,且滴加速度不能过快;故答案为:NaClO溶液;尿素溶液。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4C1-==2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为__________________;
(2)“反应Ⅱ”的还原剂是_______________(填化学式);
(3)“反应III”的离子方程式为____________________________________;
(4)辉铜矿的主要成分是Cu2S,可由黄铜矿(主要成分CuFeS2)通过电化学反应转变而成,有关转化如下如图 所示。转化时正极的电极反应式为___________________。
(5)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl32CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是__________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化如图,其原因是_______________。


(6)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)![]() Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K =__________________[已知Ksp(CuCl)=1.2×10-6, Ksp(Cu2S)=2.5×10-43]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g)△H<0.下图表示该反应的速率(υ)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
2Z(g)△H<0.下图表示该反应的速率(υ)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
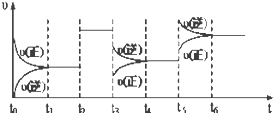
A.t3时降低了温度
B.t5时增大了压强
C.t2时加入了催化剂
D.t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO [Cu(NH3)3CO]+,2CH3COOH +2CH2=CH2+O2![]() 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。
(1)Cu2+基态核外电子排布式为______。
(2)NH3分子空间构型为_______, 其中心原子的杂化类型是______。
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是_______,1mol CH3COOCH=CH2中含![]() 键数目为_____。
键数目为_____。
(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为__________。
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构示意图表示为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适序号填写在空格上。同位素__;同一个物质__;同分异构体__;同素异形体__。
①金刚石与石墨;②D与T;③12C和13C;④O2与O3;⑤CH4和CH3-CH2-CH3;⑥CH2=CHCH3和CH2=CH2;⑦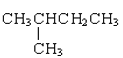 和CH3-CH2-CH2-CH2-CH3;⑧
和CH3-CH2-CH2-CH2-CH3;⑧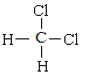 和
和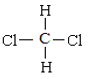
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
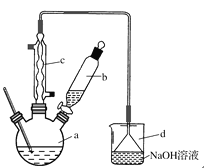
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。由b向a中加入4 mL液溴。烧瓶a中发生反应的化学方程式是______。装置d的作用是_________________;装置c的作用是__________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质的名称是________,进一步提纯操作方法是________。
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.1L0.2mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.2NA
B.H2O2+Cl2=2HCl+O2反应中,每生成32gO2,转移2NA个电子
C.3.6gCO和N2的混合气体含质子数为1.8NA
D.常温常压下,30g乙烷气体中所含共价键的数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷(![]() )、环氧丙烷(
)、环氧丙烷(![]() )都是重要的化工原料且用途广泛。回答下列问题:
)都是重要的化工原料且用途广泛。回答下列问题:
(1)已知:
①![]()
![]()
②2![]()
![]()
![]()
③![]()
![]()
![]()
![]() _____
_____![]()
(2)某温度下,物质的量均为1mol的CH2=CH2和O2在0.5L的刚性容器内发生反应③,5min后反应达到平衡,气体总压减少了20%。
①平衡时CH2=CH2(g)的转化率为____,达到平衡后,欲增加CH2=CH2(g)的平衡转化率,可采取的措施是____(填一条措施即可)。
②0~5min内,环氧乙烷的生成速率为____。
③该反应的平衡常数K_____(精确到0.01)。
④当进料气CH2=CH2和O2的物质的量不变时,T1℃时达到反应平衡,请在图1中画出温度由T1℃变化到T2℃的过程中乙烯的转化率与温度的关系____。
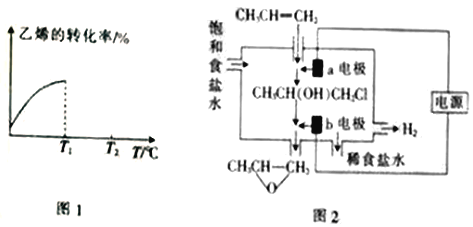
(3)将丙烯与饱和食盐水的电解产物反应,转化为氯丙醇[CH3CH(OH)CH2Cl][已知:CH3CH=CH2+H2O+Cl2→CH3CH(OH)CH2Cl+HCl],氯丙醇进一步反应生成环氧丙烷,其电解简易装置如图2所示。
①a电极上的电极反应式为______。
②b电极区域生成环氧丙烷的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HecK反应是偶联反应的一种,例如:![]() +
+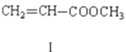
![]()
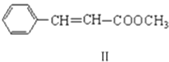 。化合物Ⅰ可以由以下途径合成:Ⅲ(分子式C3H6)
。化合物Ⅰ可以由以下途径合成:Ⅲ(分子式C3H6)![]() Ⅳ
Ⅳ![]() Ⅴ
Ⅴ![]() I
I
(1)化合物Ⅱ的分子式为_______,1mol该物质最多可与________molH2发生加成反应。
(2)卤代烃CH3CHBrCH3发生消去反应可以生成化合物Ⅲ,相应的化学方程为_______(注明条件)。
(3)化合物Ⅳ含有甲基且无支链的同系物Ⅵ的分子式为C4H6O,则化合物Ⅵ的结构简式为____;
(4)化合物Ⅴ可与CH3CH2OH发生酯化反应生成化合物Ⅶ,化合物Ⅶ在一定条件下可以发生加聚,则其加聚产物的结构简式为_____;
(5)化合物Ⅱ的一种同分异构体Ⅷ能发生银镜反应,且核磁共振氢谱只有三组峰,峰面积之比为1:2:2,Ⅷ的结构简式为____;
(6)一定条件下,![]() 与
与![]() 也可以发生类似反应①的反应,其有机产物的结构简式为_____。
也可以发生类似反应①的反应,其有机产物的结构简式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com