
【题目】药物他莫昔芬( Tamoxifen)的一种合成路线如下图所示:
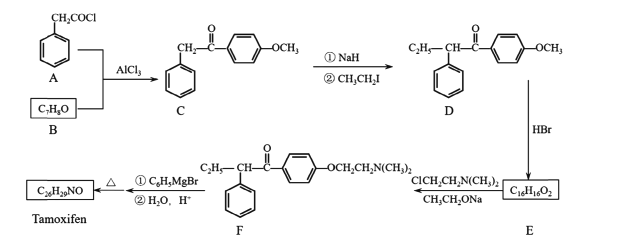
已知: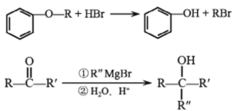
回答下列问题。
(I)A+B-C的反应类型为____;C中官能团有醚键、____(填名称)。
(2)CH3CH2I的名称为____。
(3)反应D-E的化学方程式为____。
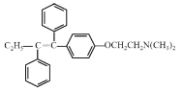
(4)Tamoxifen的结构简式为____。
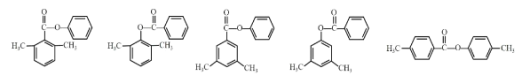
(5)X是C的同分异构体。X在酸性条件下水解,生成2种核磁共振氢谱都显示4组峰的芳香族化合物,其中一种遇FeCl3溶液显紫色。X的结构简式为_______(写2种)。
(6)设计用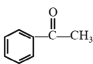 和CH3I为原料(无机试剂任选)制备
和CH3I为原料(无机试剂任选)制备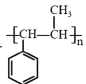 的合成路线:____。
的合成路线:____。
【答案】取代反应 羰基 碘乙烷 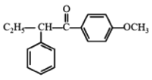 +HBr→CH3Br+
+HBr→CH3Br+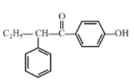
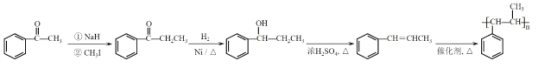
【解析】
根据A和C的结构简式,再结合B的分子式可知A与B发生取代反应(A中Cl原子被取代),B的结构简式为![]() ,C与CH3CH2I在NaH作用下发生取代生成D,D发生题目所给信息反应生成E,则E为
,C与CH3CH2I在NaH作用下发生取代生成D,D发生题目所给信息反应生成E,则E为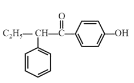 ,E中酚羟基上的氢原子被取代生成F,F发生信息反应生
,E中酚羟基上的氢原子被取代生成F,F发生信息反应生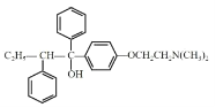 ,其分子式为C26H31NO2,对比他莫昔芬的分子式C26H29NO,可知合成路线最后一步加热时,羟基发生消去反应,所以他莫昔芬的结构简式为
,其分子式为C26H31NO2,对比他莫昔芬的分子式C26H29NO,可知合成路线最后一步加热时,羟基发生消去反应,所以他莫昔芬的结构简式为 。
。
(1)根据反应前后物质的结构可知A+B-C的反应类型为取代反应;C为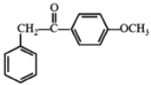 ,其官能团为羰基、醚键;
,其官能团为羰基、醚键;
(2)根据系统命名法CH3CH2I的名称为一碘乙烷;
(3)D生成E发生信息所给反应,方程式为: +HBr→CH3Br+
+HBr→CH3Br+ ;
;
(4)根据分析可知他莫昔芬的结构简式为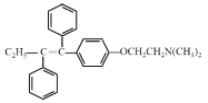 ;
;
(5)C为 ,其同分异构体满足:在酸性条件下水解生成2种核磁共振氢谱都显示4组峰的芳香族化合物,其中一种遇FeCl3溶液显紫色,则含有酯基,且水解产物中含有酚羟基,则形成酯基的羟基为酚羟基;产物均为核磁共振氢谱都显示4组峰的芳香族化合物,说明含有苯环,且结构对称,则满足条件的X有:
,其同分异构体满足:在酸性条件下水解生成2种核磁共振氢谱都显示4组峰的芳香族化合物,其中一种遇FeCl3溶液显紫色,则含有酯基,且水解产物中含有酚羟基,则形成酯基的羟基为酚羟基;产物均为核磁共振氢谱都显示4组峰的芳香族化合物,说明含有苯环,且结构对称,则满足条件的X有: ;
;
(6)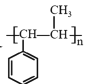 的单体为
的单体为![]() ,则问题的关键就转化为如何用
,则问题的关键就转化为如何用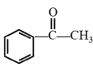 和CH3I合成该单体,原料有卤代烃,题目所给流程中C到D过程中反应物为卤代烃,可以参照此反应,
和CH3I合成该单体,原料有卤代烃,题目所给流程中C到D过程中反应物为卤代烃,可以参照此反应,  和CH3I发生C到D反应后碳链可以加长,产物中含有羰基,羰基加成可以生成羟基,羟基消去可以生成碳碳双键,所以合成路线为:
和CH3I发生C到D反应后碳链可以加长,产物中含有羰基,羰基加成可以生成羟基,羟基消去可以生成碳碳双键,所以合成路线为:
 。
。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜精炼后的阳极泥中含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的工艺流程如图所示:
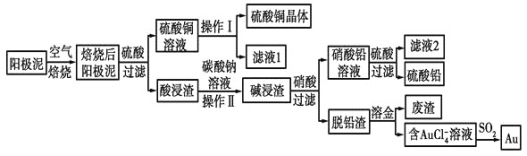
(1)电解精炼含铜、金、铅的粗铜时,电解液应该用________溶液作电解液,电解时阳极的电极反应式为___________________________和Cu-2e-=Cu2+。
(2)完成操作Ⅰ的主要步骤有:__________________,过滤,洗涤,干燥。
(3)写出用SO2还原AuCl4-的离子反应方程式____________________________。
(4)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法________________________。
(5)用离子方程式表示加入碳酸钠溶液的作用:___________________________。[已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)=1.82×10-8]。当溶液中c(SO42-)=0.2mol/L时,c(CO32-)=________mol/L。![]() 结果保留2位有效数字
结果保留2位有效数字![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A.1 mol·L-1盐酸中,Cl-数为NA
B.58 g正丁烷中,共价键数为10 NA
C.常温常压下,2. 24 L O2中氧分子数为0.2NA
D.密闭容器中,3 mol H2和1 mol N2充分反应后原子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。已知:2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
N2(g)+O2(g)=2NO(g)△H=+181 kJ/mol,
则:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=__kJ/mol;
N2(g)+2CO2(g)△H=__kJ/mol;
下列措施能够增大此反应中NO的转化率的是___(填字母序号)
a.增大容器的体积 b.降低温度 c.增大CO的浓度 d.增大NO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.20 | 0.70 | 0.70 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.40 | 0.65 | 0.65 | 0.75 | 0.80 | 0.80 |
①0~5min内,以NO表示的该反应速率υ(NO)=__________,该条件下的平衡常数K=___________(保留2位小数)。
②第15min后,温度调整到T2,数据变化如上表所示,则T1___________T2(填“>”、“<”或“=”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol·L-1)时,溶液中c(Ag+)为__mol·L-1,此时溶液中c(CrO42-)等于____mol·L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.往碘化亚铁中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.硝酸银溶液中加入过量氨水:Ag+ +NH3·H2O=AgOH↓+NH4+
D.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。回答下列问题
(1)Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________。
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。H2S分子VSEPR模型为____________,(NH4)2MoO4中所有元素的第一电离能由大到小的顺序为________________;MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是___________________________。
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2+4H2+2Na2CO3![]() Mo+2CO+4H2O+2Na2S,分子或离子中的大π键可用符号
Mo+2CO+4H2O+2Na2S,分子或离子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则碳酸钠中CO32-离子中的大π键应表示为________。
),则碳酸钠中CO32-离子中的大π键应表示为________。
(4)钼的一种配合物化学式为:Na3[Mo(CN)8]8H2O,其中除共价键、配位键以外还存在的作用力有_____________,其中配体离子中σ键与π键数目之比为_________。
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为_________堆积。若晶体钼的密度为ρg·cm-3,钼原子半径为r pm,NA表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为__________________(用含有ρ、r、NA、M的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊噻嗪是治疗水肿及高血压的药物,其中间体G的一种合成路线如下:
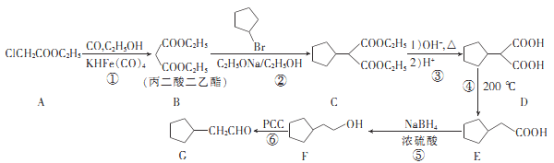
回答下列问题:
(1)A的化学名称是__________。B中含有官能团的名称为___________。
(2)反应②的反应类型是____________。
(3)G与新制Cu(OH)2反应的化学方程式为__________________。
(4)X与E互为同分异构体,X中含有六元碳环,且X能与NaOH溶液反应,则符合条件的X的结构简式为___________________。
(5)设计由1,3-丙二醇和丙二酸二乙酯制备![]() 的合成路线(其他试剂任选)。_____________
的合成路线(其他试剂任选)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化合物的分子式为AB2,A属ⅥA族元素,B属ⅦA族元素,A和B在同一周期,它们的电负性值分别为3.44和3.98,已知AB2分子的键角为103.3。。下列推断不正确的是( )
A.AB2分子的空间构型为“V”形
B.A---B键为极性共价键,AB2分子为非极性分子
C.AB2与H2O相比,AB2的熔点、沸点比H2O的低
D.AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com