
【题目】金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。回答下列问题
(1)Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________。
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。H2S分子VSEPR模型为____________,(NH4)2MoO4中所有元素的第一电离能由大到小的顺序为________________;MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是___________________________。
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2+4H2+2Na2CO3![]() Mo+2CO+4H2O+2Na2S,分子或离子中的大π键可用符号
Mo+2CO+4H2O+2Na2S,分子或离子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则碳酸钠中CO32-离子中的大π键应表示为________。
),则碳酸钠中CO32-离子中的大π键应表示为________。
(4)钼的一种配合物化学式为:Na3[Mo(CN)8]8H2O,其中除共价键、配位键以外还存在的作用力有_____________,其中配体离子中σ键与π键数目之比为_________。
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为_________堆积。若晶体钼的密度为ρg·cm-3,钼原子半径为r pm,NA表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为__________________(用含有ρ、r、NA、M的代数式表示)。

【答案】![]() 四面体形 N>O>H>Mo 层与层之间的范德华力较弱,外力作用下易发生滑动 Π46 离子键、氢键 1:2 体心立方堆积
四面体形 N>O>H>Mo 层与层之间的范德华力较弱,外力作用下易发生滑动 Π46 离子键、氢键 1:2 体心立方堆积 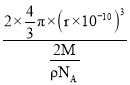
【解析】
(1)①Mo与Cr是同族元素,并且位于相邻周期,则Mo处于周期表中第五周期VIB族,价电子排布式4d55s1,价电子轨道排布图为:![]() ;
;
(2)H2S中心原子S原子价层电子对数为![]() =4,VSEPR模型为正四面体;一般金属性越强第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于氧元素的,故第一电离能:N>O>H>Mo;具有类似于石墨的层状结构,层与层之间的范德华力较弱,在外力作用下容易发生滑动,具有优异的润滑性能;
=4,VSEPR模型为正四面体;一般金属性越强第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,N原子2p轨道为半充满稳定状态,第一电离能高于氧元素的,故第一电离能:N>O>H>Mo;具有类似于石墨的层状结构,层与层之间的范德华力较弱,在外力作用下容易发生滑动,具有优异的润滑性能;
(3)CO32-中,C原子为sp2杂化,空间构型为平面三角形,碳原子上有一个垂直于分子平面的p轨道;端位的3个氧原子也各有1个垂直于分子平面的p轨道,离子价电子总数为3×6+4+2=24,3个C-O键有6个电子,每个氧原子上有2对不与分子平面垂直的孤对电子对,因此4个平行p轨道中共有24-6-3×4=6个电子,所以CO32-离子中有1个4轨道6电子大π键,所以记为![]() ;
;
(4)还存在Na+与[Mo(CN)8]3-之间的离子键以及水分子之间的氢键;配体离子为CN-,碳氮之间为三键,含有1个σ键和2个π键,所以数目比为1:2;
(5)如图金属钼晶体中的原子堆积方式中,Mo原子处于立方体的体心与顶点,属于体心立方堆积;晶胞中Mo原子数目=1+8×![]() =2,故晶胞中Mo原子总体积=2×
=2,故晶胞中Mo原子总体积=2×![]() π×(r×10-10 cm)3,晶胞质量=
π×(r×10-10 cm)3,晶胞质量=![]() g,则晶胞体积=2×
g,则晶胞体积=2×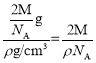 cm3,晶胞中原子的空间利用率=
cm3,晶胞中原子的空间利用率=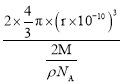 。
。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为_________________________;该反应在________条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
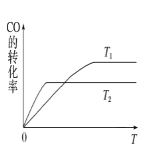
①T1________T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1________(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________(填字母)。
a.降低温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___________________;
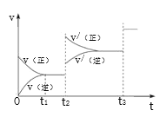
t3时采取的措施可能是 _________________。
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。负极加入的物质是________;正极的电极反应为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
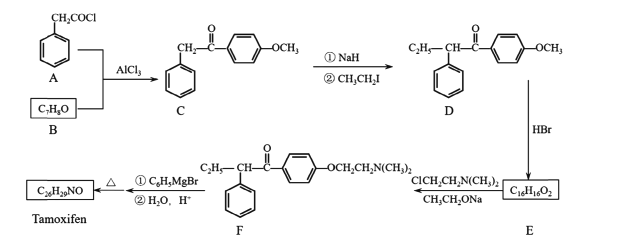
【题目】药物他莫昔芬( Tamoxifen)的一种合成路线如下图所示:
已知: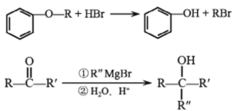
回答下列问题。
(I)A+B-C的反应类型为____;C中官能团有醚键、____(填名称)。
(2)CH3CH2I的名称为____。
(3)反应D-E的化学方程式为____。
(4)Tamoxifen的结构简式为____。
(5)X是C的同分异构体。X在酸性条件下水解,生成2种核磁共振氢谱都显示4组峰的芳香族化合物,其中一种遇FeCl3溶液显紫色。X的结构简式为_______(写2种)。
(6)设计用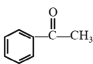 和CH3I为原料(无机试剂任选)制备
和CH3I为原料(无机试剂任选)制备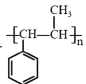 的合成路线:____。
的合成路线:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是
A.酸性:![]()
B.热稳定性:Na2 CO3![]() NaHCO3
NaHCO3
C.与水反应的速率:Na![]() Mg
Mg
D.非金属性:Cl![]() Br
Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所得出的相应结论正确的是
实验事实 | 结论 | |
A | 在相同温度下,向1 mL0.2 mol/LNaOH溶液中滴入2滴0.1 mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
B | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体水溶液一定显碱性 |
C | 同温同压下,等体积pH=3的HA和HB两种酸分别于足量的锌反应,排水法收集气体,HA放出的氢气多且反应速率快 | HB的酸性比HA强 |
D | SiO2既能与氢氟酸反应又能与碱反应 | SiO2是两性氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com