
【题目】X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示![]() 水及部分产物已略去
水及部分产物已略去![]() .
.
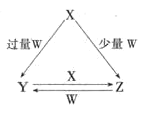
(1)若X为金属单质,W是某强酸的稀溶液.X与过量W反应生成Y的离子方程式为 ______ ;组成X的元素在周期表中的位置是 ______ .
(2)若X为非金属单质,W是空气的主要成分之一.它们之间转化的能量变化如图A所示,则X+W→Z的热化学方程式为 ______ .
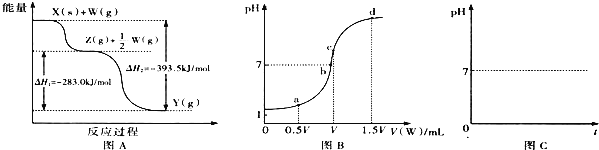
(3)若X、Y为正盐,X的水溶液显酸性,W为一元强碱(化学式为MOH),则X与过量W反应生成Y的离子方程式为 ______ ![]() 室温下,若用0.1mol/L的W溶液滴定VmL0.1mol/LHA溶液,滴定曲线如图B所示,则a、b、c、d四点溶液中水的电离程度最大的是 ______ 点;a点溶液中离子浓度的大小顺序为 ______ .
室温下,若用0.1mol/L的W溶液滴定VmL0.1mol/LHA溶液,滴定曲线如图B所示,则a、b、c、d四点溶液中水的电离程度最大的是 ______ 点;a点溶液中离子浓度的大小顺序为 ______ .
(4)若X为强碱,常温下W为有刺激性气味的气态氧化物.常温时,将Z的水溶液露置于空气中,请在图C中画出其pH随时间(t)的变化趋势曲线图![]() 不考虑水的挥发
不考虑水的挥发![]() ______ .
______ .
【答案】Fe+4H++NO3-= Fe3++NO↑+2H2O 第四周期VIII族 C(s)+![]() O2(g)=CO(g) H=-110.5kJ/mol Al3++4OH-=AlO2-+2H2O c c(A-)>c(M+) >c(H+)>c(OH-)
O2(g)=CO(g) H=-110.5kJ/mol Al3++4OH-=AlO2-+2H2O c c(A-)>c(M+) >c(H+)>c(OH-) 
【解析】
(1)若X为金属单质,W是某强酸的稀溶液,由转化关系可知,X为变价金属为Fe,W为硝酸,Y是硝酸铁,Z是硝酸亚铁;
(2)若X为非金属单质,X和W反应生成物与W的量有关,则X是变价元素,W是空气的主要成分之一,则X为碳、W为氧气,Y是二氧化碳,Z是一氧化碳;
(3)若X、Y为正盐,X的水溶液显酸性,W为一元强碱(化学式为MOH),X为铝盐、Y为偏铝酸盐、Z为氢氧化铝;
(4)若X为强碱,常温下W为有刺激性气味的气态氧化物,则W为SO2、Z为亚硫酸盐,Y为亚硫酸氢盐。
(1)若X为金属单质,W是某强酸的稀溶液,由转化关系可知,X为变价金属为Fe,W为硝酸,Y是硝酸铁,Z是硝酸亚铁,铁和过量硝酸反应生成硝酸铁、一氧化氮和水,离子方程式为:Fe+4H++NO3-= Fe3++NO↑+2H2O,铁位于第四周期VIII族,
(2)若X为非金属单质,X和W反应生成物与W的量有关,则X是变价元素,W是空气的主要成分之一,则X为碳、W为氧气,Y是二氧化碳,Z是一氧化碳,碳和少量氧气反应生成一氧化碳,根据图知H=-393.5-(-283.0)=-110.5kJ/mol,所以该热化学反应方程式为C(s)+![]() O2(g)=CO(g) H=-110.5kJ/mol;
O2(g)=CO(g) H=-110.5kJ/mol;
(3)若X、Y为正盐,X的水溶液显酸性,W为一元强碱(化学式为MOH),X为铝盐、Y为偏铝酸盐、Z为氢氧化铝,铝离子和过量强碱反应生成偏铝酸盐和水,离子方程式为Al3++4OH-=AlO2-+2H2O,酸或碱抑制水电离,含有弱根离子的盐促进水电离,根据图知,a、b点酸过量,d碱过量,c点二者恰好反应生成强碱弱酸盐,则水的电离程度最大,a点溶液中溶质是等物质的量浓度的HA和MA,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(H+)+ c(M+)=c(OH-)+ c(A-),所以c(A-)>c(M+),酸的电离程度较小,所以c(M+)> c(H+),则离子浓度大小顺序是c(A-)>c(M+) >c(H+)>c(OH-);
(4)若X为强碱,常温下W为有刺激性气味的气态氧化物,则W为SO2、Z为亚硫酸盐,Y为亚硫酸氢盐,Z是亚硫酸盐,为强酸弱碱盐,亚硫酸根离子水解生成亚硫酸,亚硫酸不稳定,易被氧气氧化生成硫酸,硫酸是强电解质,完全电离导致溶液中氢离子浓度增大,溶液的酸性增强,则pH逐渐减小,所以其图象为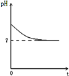 。
。


科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
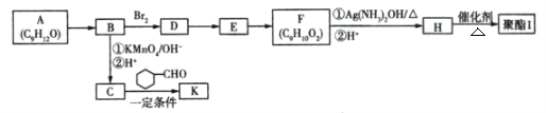
已知:①A的苯环上只有一个支链,支链上有两种不同化学环境的氢原子;
②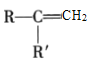
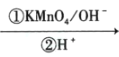
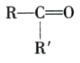 +CO2
+CO2
③![]()
回答下列问题:
(1)A生成B的反应条件为____,由D生成E的反应类型为_________。
(2)F中含有的官能团名称为________。
(3)K中含有两个六元环,则K的结构简式为 ______。
(4)由F生成H过程中①的化学方程式为_______ 。
(5)H有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式 __________。
①能发生银镜反应 ⑦遇FeCl3溶液显色 ③具有4组核磁共振氢谱峰
(6)糠叉丙酮![]() 是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[ (CH3)3COH]和糠醛
是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[ (CH3)3COH]和糠醛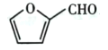 为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________
为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它是三原子分子,其摩尔质量为M g·mol--1。NA表示阿伏加德罗常数的数值,则下列说法正确的是( )
A.该气体的物质的量为![]() mol
mol
B.该气体所含原子总数为![]() NA
NA
C.该气体在标准状况下的体积为![]() L
L
D.该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
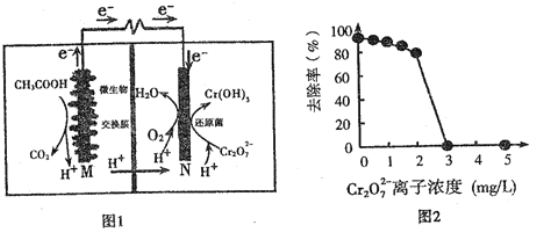
A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
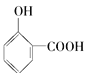
【题目】下面的排序不正确的是
A. 晶体熔点的高低: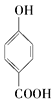 >
>
B. 硬度由大到小:金刚石>碳化硅>晶体硅
C. 熔点由高到低:Na>Mg>Al
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.甲装置的导线中有电流,电流方向为锌→铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用浓盐酸和二氧化锰制氯气的实验装置如图所示:

(1)下列气体实验室制备时,可以用相同发生装置的是 _______
A.O2 B. H2 C.HCl D. CO2
(2)制得的氯气中还含有氯化氢杂质,可通过装有______的洗气瓶除去。
(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为___________;漂白粉在空气中很容易变质,请写出漂白粉在空气中变质的反应方程式____。
(4)据报道,日常生活中,将洁厕液(主要成分是HCl)与84消毒液(主要成分是次氯酸钠)混合使用会发生中毒的事故,生成有毒的氯气。写出反应的化学方程式______。
(5)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气。用浓盐酸和高锰酸钾制氯气的反应方程式如下: KMnO4 + HCl= KCl + MnCl2 + Cl2↑+ H2O
①配平该反应的化学方程式______。
②用“单线桥”在上述方程式上标出电子转移的方向和数目______。该反应中______元素被氧化,起酸性作用的HCl是______mol。当有1mol电子转移时,可生成气体(标准状态下)______ 升。
(6)(如图)有人做了一个改进实验。挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可以看到明显的燃烧现象(金属网用以防止气体混合爆炸)。

①用此装置模拟工业合成盐酸。则相应试剂选择正确的是_________(选填序号)。
溶液A | 固体B | 气体C | |
a | 稀硫酸 | Zn | Cl2 |
b | 浓盐酸 | MnO2 | H2 |
c | 稀硝酸 | Fe | Cl2 |
d | 浓盐酸 | KMnO4 | H2 |
②管口可观察到的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
(2)Co能形成[Co(CNO)6]3-。
①1 mol该离子中含有σ键的数目为________。
②与CNO-互为等电子体的分子有_______
③C、N、O三种基态原子的第一电离能由大到小的顺序为________(用元素符号表示)。
④在相同的压强下,CO晶体的熔点高于N2晶体的原因为_______________________。
(3)BN晶体有多种结构,其中立方氮化硼具有金刚石型结构(如图)。

①晶体的最小环中含有________个B原子。
②若晶胞参数为a nm,晶胞密度为ρ g·cm-3,则阿伏加德罗常数的值可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是
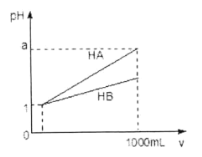
A. 同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B. 物质的量浓度HA<HB
C. 若1<a<4,则HA、HB都是弱酸
D. 体积相同pH均为1的HA、HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com