
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.甲装置的导线中有电流,电流方向为锌→铜
科目:高中化学 来源: 题型:
【题目】下列有关实验操作,说法正确的是
A. 配制一定物质的量浓度溶液时,容量瓶中有少量的水会导致溶液浓度偏低
B. 用盐酸标准溶液滴定未知浓度氨水,选用酚酞做指示剂的结果比甲基橙更准确
C. 测定硫酸铜晶体中结晶水含量时,加热后的坩埚应直接放置在石棉网上冷却
D. 测定中和热时,应迅速将酸、碱稀溶液在有保温措施的容器内混合、搅拌,记录最高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20℃1LH2S的饱和溶液中,浓度约为0.1mol·L-1,其电离方程式为:H2S![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-,若使该溶液c(S2-)增大,可采用的措施是
H++S2-,若使该溶液c(S2-)增大,可采用的措施是
A.加入适量NaOH固体B.加入适量水
C.通入硫化氢气体D.加入适量CuSO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
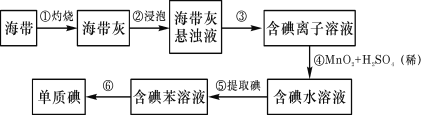
请填写下列空白:
(1)从海带中提取碘元素的步骤中,选用的实验仪器不能都用到的是____
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧
A.海带灼烧灰化,选用①②⑧ B.加水浸泡加热,选用②④⑦
C.过滤得到滤液,选用④⑤⑦ D.萃取和分液,选用③④⑥
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是_____。(选填序号)
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小于水
c.碘在苯中溶解度大于水 d.苯与水互不相溶
提取碘的过程中,不能使用的有机溶剂是__________。(选填序号)
a.酒精 b.汽油 c.四氯化碳
(3)步骤④中MnO2的作用是__________(选填:氧化剂、还原剂、催化剂)。
(4)单质碘有许多用途,其中之一是生产加碘食盐中的碘剂——碘酸钾(KIO3)。合格加碘食盐含碘量(以I计)为20-50mg/Kg,则每千克该加碘食盐中碘酸钾的最小质量为_____ mg。
(5)已知:2Fe3++2I-=2Fe2++I2 氯气既可以氧化Fe2+,也可以氧化I-。往200mLFeI2溶液中通入8.96L(标准状况)Cl2,反应完成后,溶液中有![]() Fe2+被氧化,则原FeI2溶液的物质的量浓度_______。
Fe2+被氧化,则原FeI2溶液的物质的量浓度_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示![]() 水及部分产物已略去
水及部分产物已略去![]() .
.
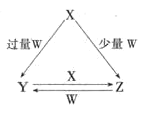
(1)若X为金属单质,W是某强酸的稀溶液.X与过量W反应生成Y的离子方程式为 ______ ;组成X的元素在周期表中的位置是 ______ .
(2)若X为非金属单质,W是空气的主要成分之一.它们之间转化的能量变化如图A所示,则X+W→Z的热化学方程式为 ______ .
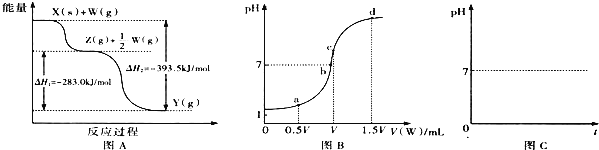
(3)若X、Y为正盐,X的水溶液显酸性,W为一元强碱(化学式为MOH),则X与过量W反应生成Y的离子方程式为 ______ ![]() 室温下,若用0.1mol/L的W溶液滴定VmL0.1mol/LHA溶液,滴定曲线如图B所示,则a、b、c、d四点溶液中水的电离程度最大的是 ______ 点;a点溶液中离子浓度的大小顺序为 ______ .
室温下,若用0.1mol/L的W溶液滴定VmL0.1mol/LHA溶液,滴定曲线如图B所示,则a、b、c、d四点溶液中水的电离程度最大的是 ______ 点;a点溶液中离子浓度的大小顺序为 ______ .
(4)若X为强碱,常温下W为有刺激性气味的气态氧化物.常温时,将Z的水溶液露置于空气中,请在图C中画出其pH随时间(t)的变化趋势曲线图![]() 不考虑水的挥发
不考虑水的挥发![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答问题:
Ⅰ.常温下,CaS的Ksp=10-8,饱和溶液中存在平衡: CaS(s)![]() Ca2+(aq)+S2-(aq)
Ca2+(aq)+S2-(aq)
(1)①该温度下,将10-4mol/L氯化钙溶液与2×10-4mol/L硫化钠溶液等体积混合,能否产生沉淀?答___;温度升高时,Ksp__(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)___,原因是___(用文字和离子方程式说明)。
(2)若向CaS悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___。
Ⅱ.(已知Ksp[Fe(OH)3]=10-38)若0.01mol/L FeCl3溶液中,如果要生成Fe(OH)3沉淀,应调整溶液pH,使pH___,若要使其沉淀完全,pH应___。(提示:填数据时,要有>,<,=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铁氧化还原液流电池工作原理如图所示

下列说法正确的是( )
A.膜X、膜Y分别是阴离子、阳离子交换膜
B.放电时,M极上的电势比N极上的高
C.放电时,负极电极反应式为:Zn+4OH--2e=Zn(OH)42-
D.充电时,阳极电极反应式为:Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用乙醇制备溴乙烷:CH3CH2OH+HBr![]() CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
A.制备过程中可能看到有气泡产生
B.可以将适量的NaBr、H2SO4(浓![]() 、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
C.如在夏天做制备CH3CH2Br的实验,实际收集到的产物可能较少
D.为了除去CH3CH2Br中混有的HBr,可用热的NaOH溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家将水置于足够强的电场中,在 20℃时水分子瞬间凝固可形成“暖冰”。某兴趣小组做如图所示实验,发现烧杯中酸性 KMnO4 溶液褪色,且有气泡产生。将酸性 KMnO4 溶液换成FeCl3 溶液,烧杯中溶液颜色无变化,但有气泡产生。则下列说法中正确的是
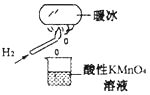
A. 20 ℃时,水凝固形成的“暖冰”所发生的变化是化学变化
B. “暖冰”是水置于足够强的电场中形成的混合物
C. 烧杯中液体为FeCl3 溶液时,产生的气体为Cl2
D. 该条件下H2 燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com