
【题目】在20℃1LH2S的饱和溶液中,浓度约为0.1mol·L-1,其电离方程式为:H2S![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-,若使该溶液c(S2-)增大,可采用的措施是
H++S2-,若使该溶液c(S2-)增大,可采用的措施是
A.加入适量NaOH固体B.加入适量水
C.通入硫化氢气体D.加入适量CuSO4固体
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】某大型精炼铜厂,在电解铜的阳极泥中含有3-14℅Se元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金属及贵金属。人体缺乏Se就会得“克山病”,Se也是制光电池的一种原料。从阳极泥中提取Se的流程如下:
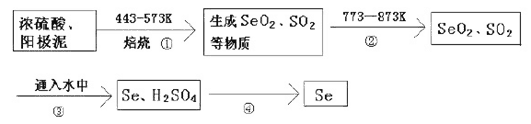
(1)流程②的目的是_________________.流程④操作用到的玻璃仪器有烧杯、______________。
H2SeO3与SO2的离子反应方程式为_____________________________________。
(2)上述工业提取Se的流程中,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________。工业提取Se的流程中,可循环利用的物质是_________________。
(3)称取5.000g电解铜阳极泥样品以合适方法溶解,配成250.00mL混酸溶液,移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol·L-1KMnO4标准溶液{只发生Se(+4)转化为Se(+6)}。反应完全后,用0.05000mol·L-1Fe2+标准溶液滴至终点,消耗15.00mL,则电解铜阳极泥中Se的质量分数为____________。若用FeCl2溶液为Fe2+标准溶液滴至终点,对测定Se的质量分数结果是否有影响,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法不正确的是( )

A.金合欢醇的同分异构体中不可能有芳香烃类
B.金合欢醇可发生加成反应、取代反应、氧化反应
C.金合欢醇分子的分子式为C15H26O
D.1 mol金合欢醇与足量Na反应生成0.5 mal氢气,与足量NaHCO3溶液反应生成1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂
B. 图Ⅱ表示一定条件下进行的反应2SO2+O2![]() 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
C. 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全
D. 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它是三原子分子,其摩尔质量为M g·mol--1。NA表示阿伏加德罗常数的数值,则下列说法正确的是( )
A.该气体的物质的量为![]() mol
mol
B.该气体所含原子总数为![]() NA
NA
C.该气体在标准状况下的体积为![]() L
L
D.该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用ClCH2CH2PO(OH)2(乙烯利![]() 及Br2/CCl4(CCl4的沸点为76.8℃)等为原料制备1,2-二溴乙烷
及Br2/CCl4(CCl4的沸点为76.8℃)等为原料制备1,2-二溴乙烷![]() 沸点为131,4℃)的装置如图所示。已知a中发生的反应为ClCH2CH2PO(OH)2+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。下列说法错误的是( )
沸点为131,4℃)的装置如图所示。已知a中发生的反应为ClCH2CH2PO(OH)2+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。下列说法错误的是( )
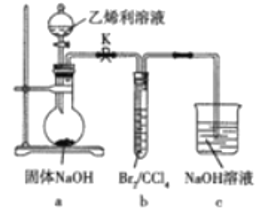
A.向圆底烧瓶中滴加乙烯利溶液前需先打开K
B.实验过程中装置b中的液体逐渐变为无色
C.装置c中的NaOH溶液的作用是吸收挥发出的Br2和乙烯
D.装置b中反应后的混合液经Na2SO3溶液洗涤、水洗、干燥、蒸馏得1,2-二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
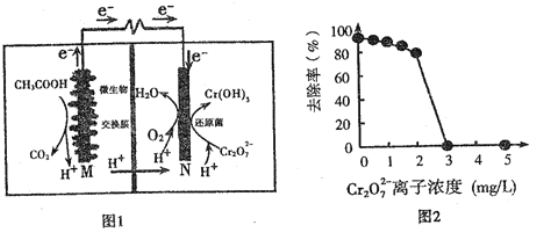
A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.甲装置的导线中有电流,电流方向为锌→铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸铵[(NH4)2Cr2O7]用作分析试剂、催化剂及媒染剂等。实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++Cr2O72+H2O = 2BaCrO4↓+2H+、4NH4++6HCHO = 3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使Cr2O72完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol·L-1 NaOH标准溶液滴定至终点,重复上述操作3次。滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.05 | 21.06 |
2 | 25.00 | 1.98 | 21.97 |
3 | 25.00 | 0.20 | 21.98 |
该样品中氮的质量分数为_________(结果保留两位小数),并写出简要的运算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com