
ЁОЬтФПЁПжиИѕЫсяЇ[(NH4)2Cr2O7]гУзїЗжЮіЪдМСЁЂДпЛЏМСМАУНШОМСЕШЁЃЪЕбщЪвГЃРћгУМзШЉЗЈВтЖЈжиИѕЫсяЇбљЦЗжаЕЊЕФжЪСПЗжЪ§ЃЌЦфЗДгІдРэЮЊ2Ba2++Cr2O72+H2O = 2BaCrO4Ё§+2H+ЁЂ4NH4++6HCHO = 3H++6H2O+(CH2)6N4H+ [ЕЮЖЈЪБЃЌ1 mol (CH2)6N4H+гы1 mol H+ЯрЕБ]ЃЌШЛКѓгУNaOHБъзМШмвКЕЮЖЈЗДгІЩњГЩЕФЫсЁЃ
ЪЕбщВНжшЃКГЦШЁбљЦЗ2.800 gЃЌХфГЩ250 mLШмвКЃЌвЦШЁ25.00 mLбљЦЗШмвКгкзЖаЮЦПжаЃЌМгШыЯѕЫсБЕШмвКЪЙCr2O72ЭъШЋГСЕэКѓЃЌМгШы10 mL 20%ЕФжаадМзШЉШмвКЃЌвЁдШЃЌОВжУ5 minКѓЃЌМгШы1~2ЕЮЗгЬЊШмвКЃЌгУ0.200 molЁЄL-1 NaOHБъзМШмвКЕЮЖЈжСжеЕуЃЌжиИДЩЯЪіВйзї3ДЮЁЃЕЮЖЈНсЙћШчЯТБэЫљЪОЃК
ЕЮЖЈДЮЪ§ | Д§ВтШмвКЕФЬхЛ§/mL | БъзМШмвКЕФЬхЛ§ | |
ЕЮЖЈЧАПЬЖШ/mL | ЕЮЖЈКѓПЬЖШ/mL | ||
1 | 25.00 | 1.05 | 21.06 |
2 | 25.00 | 1.98 | 21.97 |
3 | 25.00 | 0.20 | 21.98 |
ИУбљЦЗжаЕЊЕФжЪСПЗжЪ§ЮЊ_________(НсЙћБЃСєСНЮЛаЁЪ§)ЃЌВЂаДГіМђвЊЕФдЫЫуЙ§ГЬЁЃ
ЁОД№АИЁП10.00% (NH4)2Cr2O7 ЁЋ2N ЁЋ 4 H+ ЁЋ4NaOHЕУЕНn(N) =![]() n(NaOH) =
n(NaOH) =![]() ЁС0.200molЁЄL-1ЁС0.02LЁС10=0.02molЃЌЕЊЕФжЪСПЗжЪ§
ЁС0.200molЁЄL-1ЁС0.02LЁС10=0.02molЃЌЕЊЕФжЪСПЗжЪ§![]()
ЁОНтЮіЁП
ЯШМЦЫуЯћКФNaOHБъзМШмвКЕФЬхЛ§ЕФЦНОљжЕЃЌдйИљОнЙиЯЕЪН(NH4)2Cr2O7 ЁЋ2N ЁЋ 4 H+ ЁЋ4NaOHНјааМЦЫуЕЊЕФжЪСПЗжЪ§ЁЃ
ЯћКФЧтбѕЛЏФЦБъзМШмвКЕФЬхЛ§ЗжБ№ЮЊЃК20.01mLЁЂ19.99mLЁЂ21.78mLЃЈЮѓВюЬЋДѓЃЌЩсШЅЃЉЃЌЫљвдЦНОљЯћКФV(NaOH)=20.00mLЃЛИљОнЙиЯЕЪН(NH4)2Cr2O7 ЁЋ2N ЁЋ 4 H+ ЁЋ4NaOHЕУЕНn(N) = ![]() n(NaOH)=
n(NaOH)=![]() ЁС0.200molЁЄL-1ЁС0.02LЁС10=0.02molЃЌЕЊЕФжЪСПЗжЪ§
ЁС0.200molЁЄL-1ЁС0.02LЁС10=0.02molЃЌЕЊЕФжЪСПЗжЪ§![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК10.00%ЃЛ(NH4)2Cr2O7 ЁЋ2N ЁЋ 4 H+ ЁЋ4NaOHЕУЕНn(N) =![]() n(NaOH) =
n(NaOH) =![]() ЁС0.200 molЁЄL-1ЁС0.02L ЁС10 = 0.02molЃЌЕЊЕФжЪСПЗжЪ§
ЁС0.200 molЁЄL-1ЁС0.02L ЁС10 = 0.02molЃЌЕЊЕФжЪСПЗжЪ§![]() ЁЃ
ЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк20Ёц1LH2SЕФБЅКЭШмвКжаЃЌХЈЖШдМЮЊ0.1molЁЄLЃ1ЃЌЦфЕчРыЗНГЬЪНЮЊЃКH2S![]() HЃЋЃЋHSЃЃЌHSЃ
HЃЋЃЋHSЃЃЌHSЃ![]() HЃЋЃЋS2ЃЃЌШєЪЙИУШмвКc(S2Ѓ)діДѓЃЌПЩВЩгУЕФДыЪЉЪЧ
HЃЋЃЋS2ЃЃЌШєЪЙИУШмвКc(S2Ѓ)діДѓЃЌПЩВЩгУЕФДыЪЉЪЧ
A.МгШыЪЪСПNaOHЙЬЬхB.МгШыЪЪСПЫЎ
C.ЭЈШыСђЛЏЧтЦјЬхD.МгШыЪЪСПCuSO4ЙЬЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаПЬњбѕЛЏЛЙдвКСїЕчГиЙЄзїдРэШчЭМЫљЪО

ЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ФЄXЁЂФЄYЗжБ№ЪЧвѕРызгЁЂбєРызгНЛЛЛФЄ
B.ЗХЕчЪБЃЌMМЋЩЯЕФЕчЪЦБШNМЋЩЯЕФИп
C.ЗХЕчЪБЃЌИКМЋЕчМЋЗДгІЪНЮЊЃКZn+4OH--2e=Zn(OH)42-
D.ГфЕчЪБЃЌбєМЋЕчМЋЗДгІЪНЮЊЃКFe3++e-=Fe2+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвПЩгУввДМжЦБИфхввЭщЃКCH3CH2OH+HBr![]() CH3CH2Br+H2OЃЌЕЋЭЈГЃВЩгУфхЛЏФЦКЭХЈСђЫсгыввДМЙВШШЕФЗНЗЈЁЃЯТУцЪЧФГЭЌбЇЖдИУЪЕбщЕФВТЯыЃЌФуШЯЮЊПЩФмДэЮѓЕФЪЧЃЈ ЃЉ
CH3CH2Br+H2OЃЌЕЋЭЈГЃВЩгУфхЛЏФЦКЭХЈСђЫсгыввДМЙВШШЕФЗНЗЈЁЃЯТУцЪЧФГЭЌбЇЖдИУЪЕбщЕФВТЯыЃЌФуШЯЮЊПЩФмДэЮѓЕФЪЧЃЈ ЃЉ
A.жЦБИЙ§ГЬжаПЩФмПДЕНгаЦјХнВњЩњ
B.ПЩвдНЋЪЪСПЕФNaBrЁЂH2SO4(ХЈ![]() ЁЂCH3CH2OHШ§жжвЉЦЗжУШывЛжжШнЦїжаМгШШжЦБИCH3CH2Br
ЁЂCH3CH2OHШ§жжвЉЦЗжУШывЛжжШнЦїжаМгШШжЦБИCH3CH2Br
C.ШчдкЯФЬьзіжЦБИCH3CH2BrЕФЪЕбщЃЌЪЕМЪЪеМЏЕНЕФВњЮяПЩФмНЯЩй
D.ЮЊСЫГ§ШЅCH3CH2BrжаЛьгаЕФHBrЃЌПЩгУШШЕФNaOHШмвКЯДЕг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщзАжУЭММАЪЕбщгУЦЗОље§ШЗЕФЪЧ![]() ВПЗжМаГжвЧЦїЮДЛГі)ЃЈ ЃЉ
ВПЗжМаГжвЧЦїЮДЛГі)ЃЈ ЃЉ
A.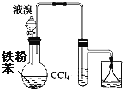 жЦфхБН
жЦфхБН
B.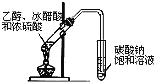 ЪЕбщЪвжЦШЁввЫсввѕЅ
ЪЕбщЪвжЦШЁввЫсввѕЅ
C. ЪЏгЭЗжСѓ
ЪЏгЭЗжСѓ
D.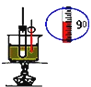 ЪЕбщЪвжЦШЁЯѕЛљБН
ЪЕбщЪвжЦШЁЯѕЛљБН
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊNH3ЦјЬх34 gЃЌЧѓЃКЃЈзЂвтЪщаДЕЅЮЛЃЉ
ЃЈ1ЃЉNH3ЕФЮяжЪЕФСПЮЊ__________________ЁЃ
ЃЈ2ЃЉNH3ЫљКЌдзгзмЪ§ЮЊ__________________ЁЃ
ЃЈ3ЃЉетаЉNH3Шмгк150 mLЫЎКѓаЮГЩШмвКЃЌУмЖШЮЊ0.9281g/cm3,дђЦфШмвКЕФЮяжЪЕФСПХЈЖШЮЊ_______________ЁЃ
ЃЈ4ЃЉгы___________gOH-гаЯрЭЌЕФЕчзгЪ§ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІЕФРызгЗНГЬЪНЃЌе§ШЗЕФЪЧЃЈ ЃЉ
A.NH4HCO3ШмгкЙ§СПЕФNaOHШмвКжаЃКHCO3-+OH-=CO32-+H2O
B.ФЦгыЫЎЗДгІЃК2Na+2H2O=2Na++2OH-+H2Ёќ
C.ТШЦјЭЈШыЫЎжаCl2+H2O=Cl-+ClO-+2H+
D.FeBr2ШмвКжаЭЈШызуСПЕФCl2ЃК2Fe2++Cl2=2Fe3++2Cl-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЦбЇМвНЋЫЎжУгкзуЙЛЧПЕФЕчГЁжаЃЌдк 20ЁцЪБЫЎЗжзгЫВМфФ§ЙЬПЩаЮГЩЁАХЏБљЁБЁЃФГаЫШЄаЁзщзіШчЭМЫљЪОЪЕбщЃЌЗЂЯжЩеБжаЫсад KMnO4 ШмвКЭЪЩЋЃЌЧвгаЦјХнВњЩњЁЃНЋЫсад KMnO4 ШмвКЛЛГЩFeCl3 ШмвКЃЌЩеБжаШмвКбеЩЋЮоБфЛЏЃЌЕЋгаЦјХнВњЩњЁЃдђЯТСаЫЕЗЈжае§ШЗЕФЪЧ
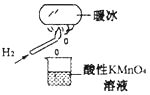
A. 20 ЁцЪБЃЌЫЎФ§ЙЬаЮГЩЕФЁАХЏБљЁБЫљЗЂЩњЕФБфЛЏЪЧЛЏбЇБфЛЏ
B. ЁАХЏБљЁБЪЧЫЎжУгкзуЙЛЧПЕФЕчГЁжааЮГЩЕФЛьКЯЮя
C. ЩеБжавКЬхЮЊFeCl3 ШмвКЪБЃЌВњЩњЕФЦјЬхЮЊCl2
D. ИУЬѕМўЯТH2 ШМЩеЕФВњЮяжаПЩФмКЌгавЛЖЈСПЕФH2O2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУЗДгІЃК2NO(g)ЃЋ2CO(g)![]() 2CO2(g)ЃЋN2(g) ЁїHЃНЃ746.8kJЁЄmolЃ1ЃЌПЩОЛЛЏЦћГЕЮВЦјЃЌШчЙћвЊЭЌЪБЬсИпИУЗДгІЕФЫйТЪКЭNOЕФзЊЛЏТЪЃЌВЩШЁЕФДыЪЉЪЧ
2CO2(g)ЃЋN2(g) ЁїHЃНЃ746.8kJЁЄmolЃ1ЃЌПЩОЛЛЏЦћГЕЮВЦјЃЌШчЙћвЊЭЌЪБЬсИпИУЗДгІЕФЫйТЪКЭNOЕФзЊЛЏТЪЃЌВЩШЁЕФДыЪЉЪЧ
A. НЕЕЭЮТЖШ B. діДѓбЙЧП
C. Щ§ИпЮТЖШЭЌЪБГфШыN2 D. МАЪБНЋCO2КЭN2ДгЗДгІЬхЯЕжавЦзп
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com