
【题目】已知NH3气体34 g,求:(注意书写单位)
(1)NH3的物质的量为__________________。
(2)NH3所含原子总数为__________________。
(3)这些NH3溶于150 mL水后形成溶液,密度为0.9281g/cm3,则其溶液的物质的量浓度为_______________。
(4)与___________gOH-有相同的电子数。
【答案】2mol 8NA 10.09mol/L 34
【解析】
(1)氨气的摩尔质量为17g/mol,根据n=![]() 计算出34g氨气的物质的量;
计算出34g氨气的物质的量;
(2)氨气分子中含有4个原子,根据N=nNA计算出该氨气中含有的原子数;
(3)根据c=![]() 计算物质的量浓度;
计算物质的量浓度;
(4)结合OH-和NH3含有的电子数和m=nM计算。
(1)34g氨气的物质的量为:n(NH3)=![]() =2mol;
=2mol;
(2)2mol氨气中含有原子的物质的量为:2mol×4=4mol,含有的原子数为:N=nNA=8NA;
(3)这些NH3溶于150 mL水后形成溶液,密度为0.9281g/cm3,则其溶液的物质的量浓度c=![]() =
=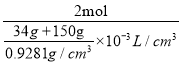 =10.09mol/L;
=10.09mol/L;
(4)2molNH3含有电子的物质的量为20mol,每个OH-含有10个电子,则有相同的电子数的OH-的物质的量为2mol,其质量为2mol×17g/mol=34g。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】利用ClCH2CH2PO(OH)2(乙烯利![]() 及Br2/CCl4(CCl4的沸点为76.8℃)等为原料制备1,2-二溴乙烷
及Br2/CCl4(CCl4的沸点为76.8℃)等为原料制备1,2-二溴乙烷![]() 沸点为131,4℃)的装置如图所示。已知a中发生的反应为ClCH2CH2PO(OH)2+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。下列说法错误的是( )
沸点为131,4℃)的装置如图所示。已知a中发生的反应为ClCH2CH2PO(OH)2+4NaOH→NaCl+CH2=CH2↑+Na3PO4+3H2O。下列说法错误的是( )
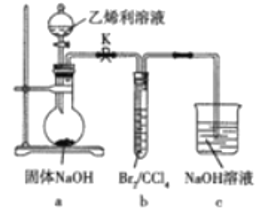
A.向圆底烧瓶中滴加乙烯利溶液前需先打开K
B.实验过程中装置b中的液体逐渐变为无色
C.装置c中的NaOH溶液的作用是吸收挥发出的Br2和乙烯
D.装置b中反应后的混合液经Na2SO3溶液洗涤、水洗、干燥、蒸馏得1,2-二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水蒸气蒸馏的方法![]() 蒸馏装置如图
蒸馏装置如图![]() 从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯
从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯![]() 柠檬烯
柠檬烯![]()
![]() 。提取柠檬烯的实验操作步骤如下:
。提取柠檬烯的实验操作步骤如下:

①将1~2个橙子皮剪成细碎的碎片,投入乙装置中,加入约30mL水;
②松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层油层。
下列说法不正确的是( )
A.当馏出液油层无明显变化时,说明蒸馏完成
B.蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热
C.为完成实验目的,应将甲中的长导管换成温度计
D.要想从精油中得到柠檬烯,还要进行萃取、分液、蒸馏操作才能实现目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是
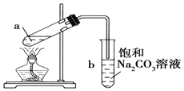
A. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B. 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
C. 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D. 采用长玻璃导管有导气兼冷凝的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸铵[(NH4)2Cr2O7]用作分析试剂、催化剂及媒染剂等。实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++Cr2O72+H2O = 2BaCrO4↓+2H+、4NH4++6HCHO = 3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使Cr2O72完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol·L-1 NaOH标准溶液滴定至终点,重复上述操作3次。滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.05 | 21.06 |
2 | 25.00 | 1.98 | 21.97 |
3 | 25.00 | 0.20 | 21.98 |
该样品中氮的质量分数为_________(结果保留两位小数),并写出简要的运算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向温度为300℃的2L密闭容器中充入2molSO2和1molO2发生反应:![]() ,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
,体系达到平衡状态后SO2的浓度为0.1mol/L,下列说法错误的是
A. 该温度下反应的平衡常数K=1620
B. SO2和O2的平衡转化率相等
C. 平衡后保持温度和容器体积不变再充入SO3(g),平衡逆向移动且平衡常数不变
D. 若不再向容器中加入任何物质,改变条件不可能使SO2的浓度达到1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(1)毒重石用盐酸浸取前需充分研磨,目的是________。
(2)实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________________。
A.烧杯 B.容量瓶 C.玻璃棒 D.滴定管
(3)加入NH3·H2O调pH=8可除去________________(填离子符号),滤渣Ⅱ中含________________(填化学式)。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+![]() Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
①BaCl2溶液的浓度为________________mol·L-1。
②若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将____________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料.
![]() 已知:
已知:![]()
![]()
写出表示甲醇燃烧热的热化学方程式 ______ .
![]() 甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.其反应为:
![]()
![]()
![]()
![]() 该反应的平衡常数表达式为 ______ .
该反应的平衡常数表达式为 ______ .
![]() 下列措施中能使平衡时
下列措施中能使平衡时![]() 减小的是
减小的是![]() 双选
双选![]() ______ .
______ .
A.加入催化剂![]() 恒容充入
恒容充入![]() ,使体系压强增大
,使体系压强增大
C.将![]() 从体系中分离
从体系中分离![]() 恒容再充入
恒容再充入![]()
![]() 甲醇可以氧化成甲酸,在常温下用
甲醇可以氧化成甲酸,在常温下用![]() NaOH溶液滴定
NaOH溶液滴定![]()
![]() 甲酸溶液过程中,当混合液的
甲酸溶液过程中,当混合液的![]() 时,所消耗的
时,所消耗的![]() ______span>
______span>
![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() .
.
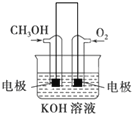
![]() 利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
利用甲醇燃烧设计为燃料电池,如图所示,则负极电极反应式为 ______ .
![]() 合成甲醇的主要反应为:
合成甲醇的主要反应为:![]() 原料气的加工过程中常常混有一些
原料气的加工过程中常常混有一些![]() ,为了研究温度及
,为了研究温度及![]() 含量对该反应的影响,以
含量对该反应的影响,以![]() 、CO和
、CO和![]() 的混合气体为原料在一定条件下进行实验.实验数据见下表:
的混合气体为原料在一定条件下进行实验.实验数据见下表:
|
|
|
|
| ||||||||
反应温度 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 |
生成 |
|
|
|
|
|
|
|
|
|
|
|
|
由表中数据可得出多个结论.
结论一:在一定条件下,反应温度越高,生成![]() 的碳转化率 ______ .
的碳转化率 ______ .
结论二: ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com