
【题目】下列反应的离子方程式,正确的是( )
A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
B.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
C.氯气通入水中Cl2+H2O=Cl-+ClO-+2H+
D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl-
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
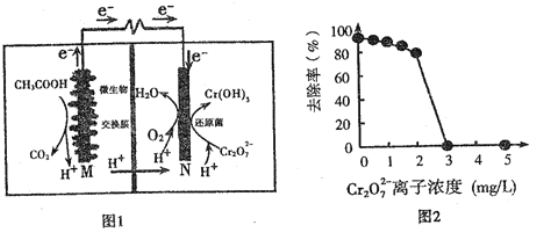
A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
(2)Co能形成[Co(CNO)6]3-。
①1 mol该离子中含有σ键的数目为________。
②与CNO-互为等电子体的分子有_______
③C、N、O三种基态原子的第一电离能由大到小的顺序为________(用元素符号表示)。
④在相同的压强下,CO晶体的熔点高于N2晶体的原因为_______________________。
(3)BN晶体有多种结构,其中立方氮化硼具有金刚石型结构(如图)。

①晶体的最小环中含有________个B原子。
②若晶胞参数为a nm,晶胞密度为ρ g·cm-3,则阿伏加德罗常数的值可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸铵[(NH4)2Cr2O7]用作分析试剂、催化剂及媒染剂等。实验室常利用甲醛法测定重铬酸铵样品中氮的质量分数,其反应原理为2Ba2++Cr2O72+H2O = 2BaCrO4↓+2H+、4NH4++6HCHO = 3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800 g,配成250 mL溶液,移取25.00 mL样品溶液于锥形瓶中,加入硝酸钡溶液使Cr2O72完全沉淀后,加入10 mL 20%的中性甲醛溶液,摇匀,静置5 min后,加入1~2滴酚酞溶液,用0.200 mol·L-1 NaOH标准溶液滴定至终点,重复上述操作3次。滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.05 | 21.06 |
2 | 25.00 | 1.98 | 21.97 |
3 | 25.00 | 0.20 | 21.98 |
该样品中氮的质量分数为_________(结果保留两位小数),并写出简要的运算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(1)毒重石用盐酸浸取前需充分研磨,目的是________。
(2)实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________________。
A.烧杯 B.容量瓶 C.玻璃棒 D.滴定管
(3)加入NH3·H2O调pH=8可除去________________(填离子符号),滤渣Ⅱ中含________________(填化学式)。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+![]() Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
Cr2O72-+2H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
①BaCl2溶液的浓度为________________mol·L-1。
②若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将____________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是
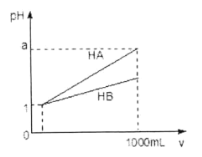
A. 同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B. 物质的量浓度HA<HB
C. 若1<a<4,则HA、HB都是弱酸
D. 体积相同pH均为1的HA、HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用甲酸钠(HCOONa)制备Na2S2O4并测定产品的纯度,实验装置(夹持、加热仪器略)如图
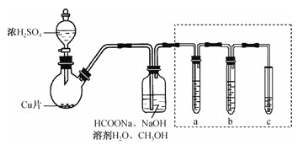
回答下列问题
(1)盛放浓硫酸的仪器名称为________,写出浓H2SO4与Cu反应的化学方程式 ________ 。
(2)SO2与HCOONa、NaOH反应生成Na2S2O4和CO2, 其离子方程式为________。
(3)图中虚线框中装置用于检验逸出气体中的CO2 , a、b、c所盛放的试剂依次为________、________、________。
(4)将反应液分离提纯得到Na2S2O4产品,取产品mg溶于水,并定容为100mL,取25.00mL加入锥形瓶中,加入NaOH溶液及指示剂,用cmol·mol-1的K3[Fe(CN)6]标准溶液进行滴定{4K3[Fe(CN)6]+2Na2S2O4+8NaOH=3K4[Fe(CN)6]+4Na2SO3+Na4[Fe(CN)6]+4H2O},滴定至终点时,消耗标准液VmL。则产品的纯度为________(写出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1mLpH=2的一元酸HA溶液加水稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是

A. 加热HA溶液时,溶液酸性增强
B. lmol/LHA溶液与1mol/LNaOH溶液等体积混合,若所得溶液中c(Na+)>c(A-),则2<a<4
C. 某浓度的NaA溶液的pH=d,则其中由水电离出的c(OH-)=1014-d
D. HA溶液与NaOH溶液恰好完全反应时,一定有c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com