
”¾ĢāÄæ”æÓĆÅØŃĪĖįŗĶ¶žŃõ»ÆĆĢÖĘĀČĘųµÄŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£ŗ

(1)ĻĀĮŠĘųĢåŹµŃéŹŅÖʱøŹ±£¬æÉŅŌÓĆĻąĶ¬·¢Éś×°ÖƵďĒ _______
A.O2 B. H2 C.HCl D. CO2
(2)ÖʵƵÄĀČĘųÖŠ»¹ŗ¬ÓŠĀČ»ÆĒāŌÓÖŹ£¬æÉĶعż×°ÓŠ______µÄĻ“ĘųĘæ³żČ„”£
(3)¹¤ŅµÉĻ½«ĀČĘųĶØČėŹÆ»ŅČé[Ca(OH)2]ÖĘČ”ĘÆ°×·Ū£¬»Æѧ·“Ó¦·½³ĢŹ½ĪŖ___________£»ĘÆ°×·ŪŌŚæÕĘųÖŠŗÜČŻŅ×±äÖŹ£¬ĒėŠ“³öĘÆ°×·ŪŌŚæÕĘųÖŠ±äÖŹµÄ·“Ó¦·½³ĢŹ½____”£
(4)¾Ż±ØµĄ£¬ČÕ³£Éś»īÖŠ£¬½«½ą²ŽŅŗ(Ö÷ŅŖ³É·ÖŹĒHCl)Óė84Ļū¶¾Ņŗ(Ö÷ŅŖ³É·ÖŹĒ“ĪĀČĖįÄĘ)»ģŗĻŹ¹ÓĆ»į·¢ÉśÖŠ¶¾µÄŹĀ¹Ź£¬Éś³ÉÓŠ¶¾µÄĀČĘų”£Š“³ö·“Ó¦µÄ»Æѧ·½³ĢŹ½______”£
(5)¶žŃõ»ÆĆĢŗĶøßĆĢĖį¼Ų¶¼ŹĒĒæŃõ»Æ¼Į£¬¾łæɽ«ÅØŃĪĖįŃõ»ÆĪŖĀČĘų”£ÓĆÅØŃĪĖįŗĶøßĆĢĖį¼ŲÖĘĀČĘųµÄ·“Ó¦·½³ĢŹ½ČēĻĀ£ŗ KMnO4 + HCl= KCl + MnCl2 + Cl2”ü+ H2O
¢ŁÅäĘ½øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½______”£
¢ŚÓĆ”°µ„ĻßĒÅ”±ŌŚÉĻŹö·½³ĢŹ½ÉĻ±ź³öµē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæ______”£øĆ·“Ó¦ÖŠ______ŌŖĖŲ±»Ńõ»Æ£¬ĘšĖįŠŌ×÷ÓƵÄHClŹĒ______mol”£µ±ÓŠ1molµē×Ó×ŖŅĘŹ±£¬æÉÉś³ÉĘųĢå(±ź×¼×“Ģ¬ĻĀ)______ Éż”£
(6)(ČēĶ¼)ÓŠČĖ×öĮĖŅ»øöøĽųŹµŃ锣¼·Ń¹ČķĖÜĮĻĘ棬Ļņ×°ÓŠ¹ĢĢåBµÄ׶ŠĪĘæÖŠ¼ÓČėČÜŅŗA£¬Ķ¬Ź±ĶłČ¼ÉÕ¹ÜÖŠĶØČėĘųĢåC²¢µćČ¼£¬æÉŅŌ擵½Ć÷ĻŌµÄČ¼ÉÕĻÖĻó(½šŹōĶųÓĆŅŌ·ĄÖ¹ĘųĢå»ģŗĻ±¬ÕØ)”£

¢ŁÓĆ“Ė×°ÖĆÄ£Äā¹¤ŅµŗĻ³ÉŃĪĖį”£ŌņĻąÓ¦ŹŌ¼ĮŃ”ŌńÕżČ·µÄŹĒ_________(Ń”ĢīŠņŗÅ)”£
ČÜŅŗA | ¹ĢĢåB | ĘųĢåC | |
a | Ļ”ĮņĖį | Zn | Cl2 |
b | ÅØŃĪĖį | MnO2 | H2 |
c | Ļ”ĻõĖį | Fe | Cl2 |
d | ÅØŃĪĖį | KMnO4 | H2 |
¢Ś¹ÜæŚæɹŪ²ģµ½µÄĻÖĻóŹĒ__________”£
”¾“š°ø”æC ±„ŗĶŹ³ŃĪĖ® 2Cl2 + Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O Ca(ClO)2 + 2CO2 + 2H2O=Ca(HCO3)2+ 2HClO 2HClO![]() 2HCl+ O2”ü 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
2HCl+ O2”ü 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O ![]() ĀČŌŖĖŲ 6 11.2 d ²Ō°×É«»šŃę£¬¹ÜæŚÉĻ·½ÓŠ°×Īķ
ĀČŌŖĖŲ 6 11.2 d ²Ō°×É«»šŃę£¬¹ÜæŚÉĻ·½ÓŠ°×Īķ
”¾½āĪö”æ
ŹµŃéŹŅÖŠÅØŃĪĖįŗĶ¶žŃõ»ÆĆĢ·“Ó¦ÖĘĀČĘųµÄ·¢Éś×°ÖĆĪŖ£ŗ¹ĢĢå+ŅŗĢ¬![]() ĘųĢ壻ĄūÓƱ„ŗĶŹ³ŃĪĖ®³żČ„HCl£¬æÉŅŌ½µµĶĀČĘųČܽā¶Č£»ÓĆĢā£Ø6£©µÄ×°ÖĆÄ£Äā¹¤ŅµŗĻ³ÉŃĪĖį£¬ŌņŌŚČ¼ÉÕ¹ÜæŚ“¦ŹĒĒāĘųÓėĀČĘų·“Ӧɜ³ÉHCl£¬ĶØČėĘųĢåCĪŖĒāĘų”¢×¶ŠĪĘæÖŠÉś³ÉµÄĘųĢåĪŖĀČĘų£¬ĒŅÖʱøĀČĘųµÄ·“Ó¦²»ŠčŅŖ¼ÓČČ”£
ĘųĢ壻ĄūÓƱ„ŗĶŹ³ŃĪĖ®³żČ„HCl£¬æÉŅŌ½µµĶĀČĘųČܽā¶Č£»ÓĆĢā£Ø6£©µÄ×°ÖĆÄ£Äā¹¤ŅµŗĻ³ÉŃĪĖį£¬ŌņŌŚČ¼ÉÕ¹ÜæŚ“¦ŹĒĒāĘųÓėĀČĘų·“Ӧɜ³ÉHCl£¬ĶØČėĘųĢåCĪŖĒāĘų”¢×¶ŠĪĘæÖŠÉś³ÉµÄĘųĢåĪŖĀČĘų£¬ĒŅÖʱøĀČĘųµÄ·“Ó¦²»ŠčŅŖ¼ÓČČ”£
£Ø1£©øĆ·¢Éś×°ÖĆĪŖ£ŗ¹ĢĢåÓėŅŗĢ¬¼ÓČČÖʱøĘųĢ壬ÓėŹµŃéŹŅÖʱøHCl×°ÖĆĻąĶ¬”£ŹµŃéŹŅÖĘŃõĘų”¢ĒāĘų”¢¶žŃõ»ÆĢ¼µÄ×°ÖĆĪŖ¹ĢŅŗ²»¼ÓČČ×°ÖĆ£»¹ŹŃ”C£»
£Ø2£©±„ŗĶŹ³ŃĪĖ®æÉŅŌ½µµĶĀČĘųŌŚĖ®ČÜŅŗÖŠµÄČܽā¶Č£¬¹ŹÓƱ„ŗĶŹ³ŃĪŹ½³żČ„ĀČĘųÖŠµÄHCl£»
£Ø3£©ĀČĘųÓėĒāŃõ»ÆøĘ·“Ӧɜ³ÉĀČ»ÆøĘ”¢“ĪĀČĖįøĘÓėĖ®£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O£»“ĪĀČĖįøĘÓėæÕĘųÖŠ¶žŃõ»ÆĢ¼”¢Ė®·“Ӧɜ³ÉĢ¼ĖįøĘ”¢HClO£¬HClOŌŚ¹āÕÕĢõ¼žĻĀ·Ö½āĪŖHClÓėŃõĘų£¬Ļą¹Ų·“Ó¦·½³ĢŹ½ĪŖ£ŗCa(ClO)2 + 2CO2 + 2H2O=Ca(HCO3)2+ 2HClO £»2HClO![]() 2HCl+ O2”ü£¬ĘÆ°×·Ū±äÖŹ£»
2HCl+ O2”ü£¬ĘÆ°×·Ū±äÖŹ£»
£Ø4£©ÓÉĢāŅāæÉÖŖ£¬HClÓė“ĪĀČĖįÄĘ·“Ӧɜ³ÉĀČ»ÆÄĘ”¢ĀČĘųÓėĖ®£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗNaClO+2HCl=NaCl+Cl2”ü+H2O£»
£Ø5£©¢Ł·“Ó¦ÖŠĆĢŌŖĖŲČ«²æ±»»¹Ō£¬ĆĢŌŖĖŲ»ÆŗĻ¼ŪÓÉ+7¼Ū½µµĶĪŖ+2¼Ū£¬×ܹ²½µµĶ5¼Ū£¬ĀČŌŖĖŲ»ÆŗĻ¼ŪÓÉHClÖŠµÄ-1ÉżøßĪŖĀČĘųÖŠµÄ0¼Ū£¬×ܹ²Éżøß2¼Ū£¬»ÆŗĻ¼ŪÉż½µ×īŠ”¹«±¶ŹżĪŖ10£¬øßĆĢĖį¼ŲĻµŹżĪŖ2£¬ĀČĘųĻµŹżĪŖ5£¬ÅäĘ½ŗó·“Ó¦·½³ĢŹ½ĪŖ£ŗ2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O£»
¢Ś·“Ó¦ÖŠ×ŖŅʵē×ÓŹżÄæĪŖ10£¬ÓƵ„ĻßĒűź³öµē×Ó×ŖŅĘĪŖ![]() £¬·“Ó¦ÖŠClŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬·¢ÉśŃõ»Æ·“Ó¦£¬ĘšĖįŠŌ×÷ÓƵÄHClÉś³ÉKCl”¢MnCl2£¬ĘšĖįŠŌ×÷ÓƵÄHClĪŖ6mol£¬µ±ÓŠ1molµē×Ó×ŖŅĘŹ±£¬Éś³ÉĀČĘųĪŖ0.5mol£¬Éś³ÉĀČĘųĢå»żŌŚ±źæöĻĀĪŖ0.5mol”Į22.4L/mol=11.2L£»
£¬·“Ó¦ÖŠClŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬·¢ÉśŃõ»Æ·“Ó¦£¬ĘšĖįŠŌ×÷ÓƵÄHClÉś³ÉKCl”¢MnCl2£¬ĘšĖįŠŌ×÷ÓƵÄHClĪŖ6mol£¬µ±ÓŠ1molµē×Ó×ŖŅĘŹ±£¬Éś³ÉĀČĘųĪŖ0.5mol£¬Éś³ÉĀČĘųĢå»żŌŚ±źæöĻĀĪŖ0.5mol”Į22.4L/mol=11.2L£»
£Ø6£©ÓĆ“Ė×°ÖĆÄ£Äā¹¤ŅµŗĻ³ÉŃĪĖį£¬ŌņŌŚČ¼ÉÕ¹ÜæŚ“¦ŹĒĒāĘųÓėĀČĘų·“Ӧɜ³ÉHCl£¬ĶØČėĘųĢåC¾ßÓŠæÉČ¼ŠŌ£¬ŌņCĪŖĒāĘų”¢×¶ŠĪĘæÖŠÉś³ÉµÄĘųĢåĪŖĀČĘų£¬ĒŅÖʱøĀČĘųµÄ·“Ó¦²»ŠčŅŖ¼ÓČČ£¬¶žŃõ»ÆĆĢŗĶÅØŃĪĖįµÄ·“Ó¦Šč¼ÓČČ²ÅÄÜ·¢£¬ÅØŃĪĖįŗĶøßĆĢĖį¼ŲŌŚ²»¼ÓČȵÄĢõ¼žĻĀæÉŅŌÉś³ÉĀČĘų£¬¹ŹdÕżČ·£»ĒāĘųŌŚ“æ¾»µÄĀČĘųÖŠČ¼ÉÕÉś³ÉĀČ»ÆĒā£¬·¢³ö²Ō°×É«µÄ»šŃę£¬ĀČ»ÆĒā¼«Ņ×ČÜÓŚĖ®£¬ŌŚ¹ÜæŚÉĻ·ÖÓėĖ®ÕōĘų½įŗĻ³ÉŃĪĖįŅŗµĪ£¬æ“µ½°×Īķ²śÉś”£


 Ķ¬²½Į·Ļ°ŗÓÄĻ“óѧ³ö°ęÉēĻµĮŠ“š°ø
Ķ¬²½Į·Ļ°ŗÓÄĻ“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆѧæĘѧŠčŅŖ½čÖś»Æѧ×ØÓĆÓļŃŌĆčŹö£¬ĻĀĮŠÓŠ¹Ų»ÆѧÓĆÓļÕżČ·µÄŹĒ
A.CCl4µÄµē×ÓŹ½£ŗ B.Cl©µÄ½į¹¹Ź¾ŅāĶ¼
B.Cl©µÄ½į¹¹Ź¾ŅāĶ¼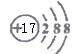
C.CO2µÄµē×ÓŹ½![]() D.ÖŹĮæŹżĪŖ37µÄĀČŌ×Ó3717Cl
D.ÖŹĮæŹżĪŖ37µÄĀČŌ×Ó3717Cl
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗCH3CH2CH2CH2OH”śCH3CH2CH2CHO
ĄūÓĆĻĀĶ¼×°ÖĆÓĆÕż¶”“¼ŗĻ³ÉÕż¶”Č©”£Ļą¹ŲŹż¾ŻČēĻĀ£ŗ
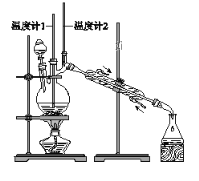
ĪļÖŹ | ·Šµć/”ę | ĆܶČ/(g”¤cm£3) | Ė®ÖŠČܽāŠŌ |
Õż¶”“¼ | 117.2 | 0.8109 | Ī¢ČÜ |
Õż¶”Č© | 75.7 | 0.8017 | Ī¢ČÜ |
ĻĀĮŠĖµ·ØÖŠ£¬²»ÕżČ·µÄŹĒ£Ø £©
A. ĪŖ·ĄÖ¹²śĪļ½ųŅ»²½Ńõ»Æ£¬Ó¦½«Ėį»ÆµÄNa2Cr2O7ČÜŅŗÖšµĪ¼ÓČėÕż¶”“¼ÖŠ
B. Ļņ»ńµĆµÄ“ÖÕż¶”Č©ÖŠ¼ÓČėÉŁĮ潚ŹōÄĘ£¬¼ģŃéĘäÖŠŹĒ·ńŗ¬ÓŠÕż¶”“¼
C. ·“Ó¦½įŹų£¬½«Įó³öĪļµ¹Čė·ÖŅŗĀ©¶·ÖŠ£¬·ÖČ„Ė®²ć£¬“ÖÕż¶”Č©“Ó·ÖŅŗĀ©¶·ÉĻæŚµ¹³ö
D. µ±ĪĀ¶Č¼Ę1Ź¾ŹżĪŖ90”«95”ę£¬ĪĀ¶Č¼Ę2Ź¾ŹżŌŚ76”ę×óÓŅŹ±£¬ŹÕ¼Æ²śĪļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢W¾łĪŖ֊ѧ»Æѧ֊³£¼ūµÄµ„ÖŹ»ņ»ÆŗĻĪļ£¬ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾![]() Ė®¼°²æ·Ö²śĪļŅŃĀŌČ„
Ė®¼°²æ·Ö²śĪļŅŃĀŌČ„![]() £®
£®
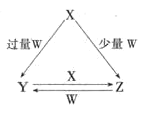
(1)ČōXĪŖ½šŹōµ„ÖŹ£¬WŹĒijĒæĖįµÄĻ”ČÜŅŗ£®XÓė¹żĮæW·“Ӧɜ³ÉYµÄĄė×Ó·½³ĢŹ½ĪŖ ______ £»×é³ÉXµÄŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ ______ £®
(2)ČōXĪŖ·Ē½šŹōµ„ÖŹ£¬WŹĒæÕĘųµÄÖ÷ŅŖ³É·ÖÖ®Ņ»£®ĖüĆĒÖ®¼ä×Ŗ»ÆµÄÄÜĮæ±ä»ÆČēĶ¼AĖłŹ¾£¬ŌņX+W”śZµÄČČ»Æѧ·½³ĢŹ½ĪŖ ______ £®
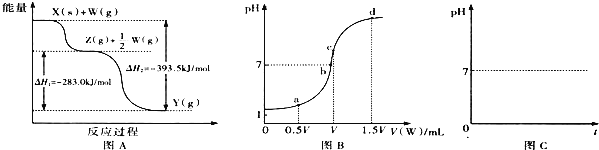
(3)ČōX”¢YĪŖÕżŃĪ£¬XµÄĖ®ČÜŅŗĻŌĖįŠŌ£¬WĪŖŅ»ŌŖĒæ¼ī(»ÆѧŹ½ĪŖMOH)£¬ŌņXÓė¹żĮæW·“Ӧɜ³ÉYµÄĄė×Ó·½³ĢŹ½ĪŖ ______ ![]() ŹŅĪĀĻĀ£¬ČōÓĆ0.1mol/LµÄWČÜŅŗµĪ¶ØVmL0.1mol/LHAČÜŅŗ£¬µĪ¶ØĒśĻßČēĶ¼BĖłŹ¾£¬Ōņa”¢b”¢c”¢dĖĵćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č×ī“óµÄŹĒ ______ µć£»aµćČÜŅŗÖŠĄė×ÓÅØ¶ČµÄ“óŠ”Ė³ŠņĪŖ ______ £®
ŹŅĪĀĻĀ£¬ČōÓĆ0.1mol/LµÄWČÜŅŗµĪ¶ØVmL0.1mol/LHAČÜŅŗ£¬µĪ¶ØĒśĻßČēĶ¼BĖłŹ¾£¬Ōņa”¢b”¢c”¢dĖĵćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č×ī“óµÄŹĒ ______ µć£»aµćČÜŅŗÖŠĄė×ÓÅØ¶ČµÄ“óŠ”Ė³ŠņĪŖ ______ £®
(4)ČōXĪŖĒæ¼ī£¬³£ĪĀĻĀWĪŖÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄĘųĢ¬Ńõ»ÆĪļ£®³£ĪĀŹ±£¬½«ZµÄĖ®ČÜŅŗĀ¶ÖĆÓŚæÕĘųÖŠ£¬ĒėŌŚĶ¼CÖŠ»³öĘäpHĖꏱ¼ä(t)µÄ±ä»ÆĒ÷ŹĘĒśĻßĶ¼![]() ²»æ¼ĀĒĖ®µÄ»Ó·¢
²»æ¼ĀĒĖ®µÄ»Ó·¢![]() ______ £®
______ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ŹĒŅ»Š©³£¼ūµÄµ„ÖŹ£¬»ÆŗĻĪļÖ®¼äµÄ×Ŗ»Æ¹ŲĻµĶ¼£¬ÓŠŠ©·“Ó¦ÖŠµÄ²æ·ÖĪļÖŹ±»ßķČ„£¬³£ĪĀ³£Ń¹ĻĀ£ŗAĪŖĪŽÉ«ÓŠ¶¾ĘųĢ壬BĪŖŗģ×ŲÉ«·ŪÄ©£¬C”¢EĪŖ½šŹōµ„ÖŹ£®·“Ó¦![]() ¾łĪŖ¹¤ŅµÉĻµÄÖŲŅŖ·“Ó¦£ŗ
¾łĪŖ¹¤ŅµÉĻµÄÖŲŅŖ·“Ó¦£ŗ

Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©![]() µÄ»ÆѧŹ½ĪŖ ______ £®
µÄ»ÆѧŹ½ĪŖ ______ £®
£Ø2£©Š“³öCŗĶNaOHČÜŅŗ·“Ӧɜ³ÉLµÄĄė×Ó·½³ĢŹ½£ŗ ______ £»
£Ø3£©Š“³öBÓėCøßĪĀ·“Ӧɜ³ÉEŗĶFµÄ»Æѧ·½³ĢŹ½£ŗ ______ £»
£Ø4£©Š“³öDÓėJµÄĻ”ČÜŅŗ·“Ӧɜ³ÉGµÄĄė×Ó·½³ĢŹ½£ŗ ______ £»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŠæĢśŃõ»Æ»¹ŌŅŗĮ÷µē³Ų¹¤×÷ŌĄķČēĶ¼ĖłŹ¾

ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.ĤX”¢Ä¤Y·Ö±šŹĒŅõĄė×Ó”¢ŃōĄė×Ó½»»»Ä¤
B.·ÅµēŹ±£¬M¼«ÉĻµÄµēŹĘ±ČN¼«ÉĻµÄøß
C.·ÅµēŹ±£¬øŗ¼«µē¼«·“Ó¦Ź½ĪŖ£ŗZn+4OH--2e=Zn(OH)42-
D.³äµēŹ±£¬Ńō¼«µē¼«·“Ó¦Ź½ĪŖ£ŗFe3++e-=Fe2+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫22æĖNaClŗĶNaBrµÄ»ģŗĻ·ŪÄ©ČÜÓŚĖ®£¬Åä³É100mLČÜŅŗ£¬ĻņČÜŅŗÖŠĶØČė×ćĮæµÄCl2ŗ󣬽«ČÜŅŗÕōøÉ£¬µĆµ½øÉŌļ¹ĢĢåµÄÖŹĮæĪŖ17.55æĖ£¬ĒóŌ»ģŗĻĪļÖŠNaClµÄĪļÖŹµÄĮæÅضČ______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé×°ÖĆĶ¼¼°ŹµŃéÓĆĘ·¾łÕżČ·µÄŹĒ![]() ²æ·Ö¼Š³ÖŅĒĘ÷Ī“»³ö)£Ø £©
²æ·Ö¼Š³ÖŅĒĘ÷Ī“»³ö)£Ø £©
A. ÖĘäå±½
ÖĘäå±½
B. ŹµŃéŹŅÖĘČ”ŅŅĖįŅŅõ„
ŹµŃéŹŅÖĘČ”ŅŅĖįŅŅõ„
C. ŹÆÓĶ·ÖĮó
ŹÆÓĶ·ÖĮó
D. ŹµŃéŹŅÖĘČ”Ļõ»ł±½
ŹµŃéŹŅÖĘČ”Ļõ»ł±½
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(NH4)3Fe(C6H5O7)2£ØÄūĆŹĖįĢśļ§£©¹ć·ŗÓĆÓŚŅ½Ń§”¢Ź³Ę·ŅµµČ”£ŹµŃéŹŅÓÉĮņĖįŃĒĢśŗĶÄūĆŹĖį£Ø  £©µČĪŖŌĮĻÖʱøÄūĆŹĖįĢśļ§²śĘ·µÄÖ÷ŅŖŹµŃéĮ÷³ĢČēĶ¼£ŗ
£©µČĪŖŌĮĻÖʱøÄūĆŹĖįĢśļ§²śĘ·µÄÖ÷ŅŖŹµŃéĮ÷³ĢČēĶ¼£ŗ
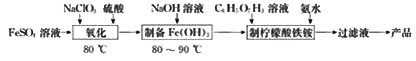
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©”°Ńõ»Æ”±Ź±£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________£ØClO3-×Ŗ»ÆĪŖCl-£©”£
£Ø2£©Ńõ»ÆŗóµÄČÜŅŗ”§ÖʱøFe(OH)3”±µÄĻźĻøŹµŃé²Ł×÷ĪŖ£ŗŌŚ²»¶Ļ½Į°čĻĀ£¬ĻņŃõ»ÆŗóµÄČÜŅŗÖŠ________”£
£Ø3£©”°ÖʱøÄūĆŹĖįĢśļ§”±µÄ×°ÖĆ£Ø¼Š³Ö¼°¼ÓČČ×°ÖĆŅŃĀŌ£©ČēĶ¼ĖłŹ¾

¢ŁĶ¼ÖŠŅĒĘ÷WµÄĆū³ĘŹĒ________”£
¢ŚFe(OH)3ÓėÄūĆŹĖį·“Ó¦Ź±ĪĀ¶ČŠčæŲÖĘŌŚ65”ę£¬ŹŹŅĖµÄ¼ÓČČ·½·ØŹĒ________£»“żFe(OH)3ĶźČ«Čܽāŗó£¬Šč½«ĪĀ¶Č½µµ½40”ęŗóŌŁµĪ¼Ó°±Ė®£¬įÓĆ½ĻµĶĪĀ¶ČµĪ¼Ó°±Ė®£¬ĘäŌŅņŹĒ________ ”£
¢ŪŗĻŹŹµÄĪ²ĘųĪüŹÕ×°ÖĆŹĒ________£ØĢī×ÖÄø£©”£
£Ø4£©ÓÉ”°¹żĀĖŅŗ”±µĆµ½²śĘ·»¹Šč¾¹żµÄ²Ł×÷ŹĒÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢________”¢øÉŌļ”£
²éæ““š°øŗĶ½āĪö>>
¹ś¼ŹŃ§Š£ÓÅŃ” - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com