
【题目】硅藻土由无定形的SiO2组成,含有少量Fe2O3、Al2O3及有机物等杂质。工业上按以下流程用硅藻土制备纳米二氧化硅。

(1)煅烧硅藻土的目的是__。
(2)在加热条件下加入烧碱时反应的化学方程式为__。
(3)加入过量硫酸后生成胶体的反应方程式为_________。
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】根据下列高分子化合物回答问题:
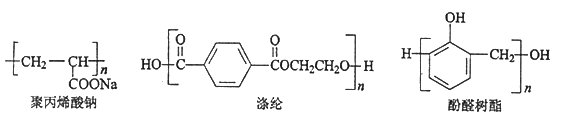
(1)合成聚丙烯酸钠的单体的结构简式是__________,反应类型是__________;
(2)合成涤纶有两种单体,其中能和NaHCO3反应的单体的结构简式是__________,其核磁共振氢谱的峰面积比是_________;
(3)①合成酚醛树脂需要两种单体,和这两种单体均可以发生反应的试剂是__________(填字母序号);
a. H2 b. Na c. Na2CO3 d. 溴水
② 和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是____________________。
和乙醛在酸性条件下也可以发生类似于制备酚醛树脂的反应,此反应的化学方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法确的是
A. 水可用来鉴别溴苯和苯
B. 聚苯乙烯不能发生加成反应
C. 用于杀菌消毒的医用酒精质量分数为95%
D. 植物油,动物脂肪和甘油都属于油脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
(1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________
②请分析CaSO4转化为CaCO3的原理:______________________________________________________
Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | K1=4.2×10-7 K2=5.6×10-11 |
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________
(2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________
(3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。
a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
A. 非金属性比硫强 B. 氢化物比HBr稳定
C. 原子序数为34 D. 最高价氧化物的水化物显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A | B | C | D |
|
|
|
|
钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸性较强,发生析氢腐蚀 | 将锌板换成铜板对钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
石英砂![]() 粗硅
粗硅![]() SiHCl3(粗)
SiHCl3(粗)![]() SiHCl3(纯)
SiHCl3(纯)![]() 高纯硅
高纯硅
①写出由纯SiHCl3制备高纯硅的化学反应方程式:_____________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出这一过程的化学反应方程式:__;H2还原SiHCl3过程中若混入O2,可能引起的后果是__________。
(2)下列有关硅材料的说法正确的是_____(填字母)。
A.碳化硅化学性质稳定,可用于生产砂纸、砂轮的磨料
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH =a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH =a kJ/mol反应过程中测定的部分数据如下表:

①反应0~2min末的平均速率v(COCl2)=_______mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =_______L/ mol。
③已知X、L可分别代表温度或压强,如图表示L一定时,CO的转化率随X的变化关系。
X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。

(2)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的NO转化率如图1所示。温度高于710K时,随温度的升高NO转化率降低的原因可能是____________________。
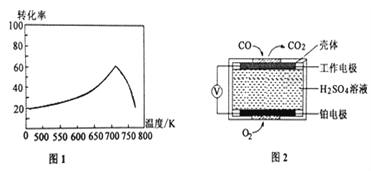
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式______________________。
(3)一定条件下,将CO和H2充入2L密闭容器中反应,可生成甲醚(CH3OCH3)。
4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
下列能判断反应达到平衡的是_______________。
A.υ(H2)=2υ(CO) B.容器内的压强不变
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变
E.甲醚的浓度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com