
【题目】下表列出了a~m13种元素在周期表(已省略了过渡元素)中的位置:
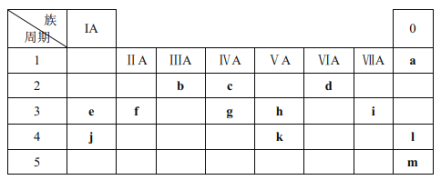
(1)元素b为___________(填名称);画出g的原子结构示意图_____________。
(2)元素f、i、j的原子半径从大到小的顺序是____________(用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是_______________(用离子符号表示)。
(3)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为_____________,该化合物中化学键有__________,该化合物与c的最高价氧化物反应的化学方程式为_________。
(4)根据元素周期表推测K元素及其化合物的性质正确的是(____)
A.气态氢化物的稳定性:K>h
B.K所在的主族元素通常用于制造农药和半导体材料
C.K的最高正价为+6
D.K的氢化物的沸点比NH3低
(5)用高能射线照射含有10电子的d元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子(含有10电子),试写出该阳离子的电子式:___________。
【答案】硼 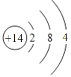 K>Mg>Cl Cl->K+>Mg2+
K>Mg>Cl Cl->K+>Mg2+  离子键、(非极性)共价键 2Na2O2+2CO2=2Na2CO3+O2 D
离子键、(非极性)共价键 2Na2O2+2CO2=2Na2CO3+O2 D ![]()
【解析】
由元素在周期表中的位置可以判断a、b、c、d、e、f、g、h、i、j、k、l、m分别为He、B、C、O、Na、Mg、Si、P、Cl、K、As、Kr、Xe等元素,结合元素周期律和相关物质的性质分析解答。
(1)元素b为硼;g是Si,原子序数是14,原子结构示意图为 。
。
(2)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则元素f、i、j的原子半径从大到小的顺序是K>Mg>Cl;核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则这三种原子分别形成简单离子后,离子半径从大到小的顺序是Cl->K+>Mg2+。
(3)元素O和Na形成的一种化合物为淡黄色固体,为过氧化钠,过氧化钠的电子式为 ,其中化学键有离子键、(非极性)共价键,该化合物与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
,其中化学键有离子键、(非极性)共价键,该化合物与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
(4)A.同主族从上到下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则气态氢化物的稳定性:K<h,A错误;
B.K所在的主族即第ⅤA元素通常用于制造农药,但一般不能制作半导体材料,B错误;
C.As的最高正价为+5价,C错误;
D.氨气分子间存在氢键,则As的氢化物的沸点比NH3低,D正确;
答案选D。
(5)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH![]() M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:

A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝原子与氯气反应时失去3个电子,钠原子与氯气反应时失去1个电子,由此得出的下列结论中不正确的是( )
A.铝的活泼性比钠的活泼性强
B.不能说明铝和钠活泼性的强弱
C.在生成的氯化物中钠元素为+1价
D.在生成的氯化物中铝元素为+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于食物的酸碱性的说法正确的是
A.食物中的主要成分能与酸反应的是碱性食物
B.食物中的主要成分能与碱反应的是酸性食物
C.食物在遇到甲基橙变红的是酸性食物,遇到酚酞变红的是碱性食物
D.食物的酸碱性应当看食物在体内代谢完全后剩余物质的酸碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:
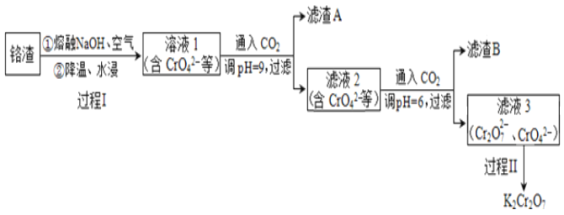
(1)铝热法冶炼金属铬,是利用了金属铝的______(填“氧化性”或“还原性”)。
(2)溶液1中的主要的阴离子有CrO42-、_____(填离子符号)。
(3)过程I,在Cr2O3参与的反应中,若生成0.4 molCrO42-,消耗氧化剂的物质的量是_______。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是_______。
②滤渣B受热分解所得物质可以循环利用,B是________(填化学式)。
③已知:2CrO42-+2H+![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04 mol/L,则CrO42-的浓度是_____mol/L。
(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
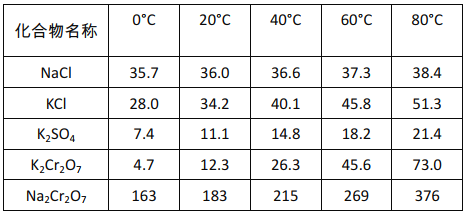
结合表中数据分析,过程II得到K2Cr2O7粗品的操作是:______,过滤得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于①乙醇、②乙酸溶液、③石灰水三种物质的说法不正确的是( )
A.只有②能与碳酸钠溶液反应
B.只有②能与烧碱溶液反应
C.①②③都能与钠反应放出氢气
D.①与钠反应产生氢气最为缓慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
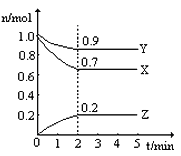
(1)该反应第_______分钟到达平衡状态 。
(2)该反应的化学方程式为____________ 。
(3)2 min时,Y的浓度为___________。
(4)反应开始至2 min,气体X的平均反应速率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH—H键、1molN≡N、1molN—H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由N2和H2反应生成1 molNH3需要_____(填“放出”或“吸收”)____kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com