
【题目】分枝酸可用于生化研究,其结构简式如图: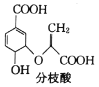 下列关于分枝酸的叙述正确的是( )
下列关于分枝酸的叙述正确的是( )
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.分枝酸最多可与3mol NaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】Fe3O4是重要的化学试剂,铁粉在氧气中燃烧是制取它最为常见和快捷的方法。
图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。

请回答下列问题:
(1)图2中仪器a的名称是________。
(2)根据题目要求,在图2中最好选择________(填序号)作为A装置。
(3)对图2中装置①进行气密性检查的方法是________,向分液漏斗中加足量水,过一会,水不再下滴,说明装置①的气密性良好。
(4)在B装置中发生的主要反应的化学方程式是_____________。
(5)当产生的气体与事先预热的铁粉接触时,在硬质玻璃管中将观察到的明显现象是_____________。
(6)反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有_________。
(7)若铁粉被完全消耗,某同学为确定生成物中有+2价铁,取少量生成物于试管中,加入适量的稀硫酸溶解。
①写出溶解过程发生反应的离子方程式____________________。
②写出确定+2价铁所用试剂名称、操作步骤、实验现象和结论__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(I)该硫酸的物质的量浓度是________。
(II)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL1.84mol/L的稀硫酸。可供选抒的仪器由:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙 请冋答下列问题:
(1) 上述仪器中,再配置稀硫酸时用不到的有________ (填代号)
(2) 经计算,需:浓硫酸的体积为_____________。现有:
①10mL ②50mL ③100mL三种规格的量筒,你选用的量筒是______ (填代号)
将上述硫酸迸行稀释的实验操作有:___________________。
(3)在配制稀硫酸过程中,其他操作都准确,能引起误差偏高的有:_________ (填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②容量瓶用1moll/L稀硫酸润洗
③转移前,容量瓶中含存少量蒸馏水
④量.取浓硫酸时俯视读刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中CO2浓度的持续走高引起人们的髙度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉” CO2的方法。
方法I :一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图1所示。

(1)太阳能加热的反应器是将_______能转化为________能。
(2)步骤二中发生反应的化学方程式是____________________ 。
方法II :另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示。

(3)NaOH溶液喷成雾状是为了_________,其中发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现:具有2、8、20、28、50、82、114、126、184等数目的质子或中子的原子核具有特别的稳定性,并将这些数称为“幻数”,而具有双幻数的He、![]() Ni、
Ni、![]() 、
、![]() 等尤为稳定。根据此信息回答下列问题:
等尤为稳定。根据此信息回答下列问题:
(1)写出元素周期表中前三种质子数为“幻数”的元素原子的结构示意图,并标明元素符号:_____________、______________、___________。
(2)已知氧有三种同位素![]() 、
、![]() 、
、![]() ,根据上述“幻数”规律,氧的同位素中原子核最稳定的是__________。
,根据上述“幻数”规律,氧的同位素中原子核最稳定的是__________。
(3)根据现有元素周期律推算,![]() R位于元素周期表的第________周期第________族,核稳定性
R位于元素周期表的第________周期第________族,核稳定性![]() R________
R________![]() R(填“>”、“<”或“=”)。
R(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素的单质及其化合物与人类的生产、生活、科研息息相关。请回答下列问题:
(1) 绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)+(s)+O2(g)+4e- △H=+1360 kJ·mol-1
12(C3H6O3)+(s)+12e- = C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200 kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为: ,
(2) 工业上利用水煤气合成甲醇的主要反应可表示为:
H2(g)+1/2CO(g)![]() 1/2CH3OH(g) △H=-45.4kJ·mol-1。
1/2CH3OH(g) △H=-45.4kJ·mol-1。
向容积为1L的密闭容器中加入0.10 mol H2和0.05mol CO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①该温度条件下,上述反应的化学平衡常数K= 。
②若容器容积不变,下列措施可增加CH3OH产率的是 (填写序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入O.10 mol H2和0.05mol CO
③若该反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,则平衡向 (填“逆向”、“正向”或“不”)移动,化学平衡常数K (填“增大”、“减小”或“不变”)。
(3) 已知反应:2CO(g)+O2(g) = 2CO2(g) △H<0,根据原电池原理该反应能否设计成燃料电池。若能,请写出当电解质溶液为KOH溶液时的负极反应式(若不能,该空可不作答): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com