
【题目】碳元素的单质及其化合物与人类的生产、生活、科研息息相关。请回答下列问题:
(1) 绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)+(s)+O2(g)+4e- △H=+1360 kJ·mol-1
12(C3H6O3)+(s)+12e- = C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200 kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为: ,
(2) 工业上利用水煤气合成甲醇的主要反应可表示为:
H2(g)+1/2CO(g)![]() 1/2CH3OH(g) △H=-45.4kJ·mol-1。
1/2CH3OH(g) △H=-45.4kJ·mol-1。
向容积为1L的密闭容器中加入0.10 mol H2和0.05mol CO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①该温度条件下,上述反应的化学平衡常数K= 。
②若容器容积不变,下列措施可增加CH3OH产率的是 (填写序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入O.10 mol H2和0.05mol CO
③若该反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,则平衡向 (填“逆向”、“正向”或“不”)移动,化学平衡常数K (填“增大”、“减小”或“不变”)。
(3) 已知反应:2CO(g)+O2(g) = 2CO2(g) △H<0,根据原电池原理该反应能否设计成燃料电池。若能,请写出当电解质溶液为KOH溶液时的负极反应式(若不能,该空可不作答): 。
【答案】(1) 2CO2(g)+2H2O(l) = C6H12O6(s,葡萄糖)+6O2(g) △H= +2880 kJ·mol-1
(2)①100(mol·L-1)-1或L·mol-1②BD③正向;不变
(3)CO-2e-+4OH-=CO32-+2H2O
【解析】
试题解析:(1)根据盖斯定律:第一个方程式×3+第二个方程式:结果为2CO2(g)+2H2O(l) = C6H12O6(s,葡萄糖)+6O2(g) △H= +2880 kJ·mol-1;(2)1摩尔氢气放热45.4 kJ;放热3.632kJ,消耗氢气为0.08摩尔;容器的体积为1升;
H2(g)+1/2CO(g) ![]() 1/2CH3OH(g) △H=-45.4kJ·mol-1。
1/2CH3OH(g) △H=-45.4kJ·mol-1。
起始 0.1 0.05 0
变化0.08 0.04 0.04
平衡 0.02 0.01 0.04
根据平衡常数计算公式:K=0.04/(0.01×0.02)= 100( mol·L-1); ②A.升高温度, 平衡左移,CH3OH(g)的量减小;错误; B.将CH3OH(g)从体系中分离,平衡右移,CH3OH(g)产率增大,正确; C.充入He,平衡不动,CH3OH(g)产率不变,错误;D.再充入O.10 mol H2和0.05mol CO相当于加压,平衡右移,CH3OH(g)产率增大;正确;答案BD;(3)氧化还原都能设计成原电池,负极发生氧化反应:CO失电子,被氧化为二氧化碳,在碱性环境中生成碳酸根离子;CO-2e-+4OH- = CO32- + 2H2O


科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图: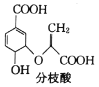 下列关于分枝酸的叙述正确的是( )
下列关于分枝酸的叙述正确的是( )
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.分枝酸最多可与3mol NaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质和用途描述错误的是
A. 铜质地漏具有独特的杀菌功能,能较好的抑制细菌生长
B. 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用
C. 铁粉具有还原性,可用作食品袋内的抗氧化剂
D. 镁燃烧发出耀眼的白光,可以制造照明弹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们的生活、生产与化学息息相关,下列说法正确的是( )
A. 地沟油主要成分是液态烃,故地沟油经过处理后可作为汽车燃油。
B. 工厂中常用的静电除尘利用了胶体电泳的性质。
C. 白铁(镀锌铁)比马口铁(镀锡铁)铁板更易腐蚀。
D. 光导纤维的成分是晶体硅。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新药的开发及药物合成是有机化学研究重要发展方向,某药物V的合成路线如下:

(1)Ⅱ中含氧官能团的名称 。
(2)反应②的化学方程式
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式
(4)下列说法正确的是
A.Ⅰ和Ⅴ均属于芳香烃 B.Ⅱ能发生银镜反应
C.1molⅡ能与4molH2发生加成反应 D.反应③属于酯化反应
(5)反应③的反应类型 反应;A的分子式
(6)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。
 写出满足上述条件的Ⅵ的结构简式
写出满足上述条件的Ⅵ的结构简式
(7)反应④的反应类型是 反应;一定条件下,化合物Ⅶ也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新合成的一种烃,其碳骨架呈三棱柱体(如图所示,碳碳键键长相等)。

(1)写出该烃的分子式__________。
(2)该烃的一氯代物是否有同分异构体_______________ 。
(3)该烃的四氯代物有多少种同分异构体____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其分子式是________。
(2)验证氯气的氧化性强于碘的实验现象是_________________________________________;
(3)B中溶液发生反应的离子方程式是_____________________________________________;
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________________________________________________________________________________________________________;
(5)过程Ⅲ实验的目的是________________________________________________________;
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下__________________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1) C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_________________。
(2)C中发生反应的离子方程式 。
(3)C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”)。
Ⅱ.实验室常用Na2SO3固体与浓硫酸反应制取SO2 :
(4)现有已制得SO2的饱和溶液,请利用此溶液(其他试剂任选),设计一个简单实验,比较SO2与Fe2+ 还原性的强弱(要求:写出实验步骤、现象和结论) 。
(5)某研究小组测定部分变质的Na2SO3固体样品中Na2SO3的含量:
① 取a克Na2SO3固体样品配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,0.0100mol/L碘水进行滴定,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
② 计算:样品中亚硫酸钠的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、锌、镍、铬及其合金在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________,基态铁原子有_________种不同运动状态的电子。
(2)镍可与CO形成配合物Ni(CO)n,CO分子中σ键与π键的个数比为________;该配合物中原子Ni的价层电子总数为18,则n=________,该配合物的熔点是170℃,则Ni(CO)n 属于__________
(3)在铬的摧化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______,乙醛分子中H—C=O的键角_______(填“大于”、“等于”或“小于”)乙醇分子中的H—C—O的键角。乙醇和乙醛均极易溶于水,其主要原因是_______________。
(4)立方NiO晶体结构类似于NaCl,则Ni2+填入O2-构成的________空隙(填“正四面体”、“正八面体”、“立方体”或“压扁八面体”)。其晶胞边长为ɑ pm,列式表示NiO晶体的密度为____g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com