
【题目】某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
实验序号 | ① | ② | ③ | ④ |
实验 内容 |
|
|
|
|
一周后观察:
(1)铁钉被腐蚀程度最大的是_____________(填实验序号)。
(2)实验③中主要发生的是__________(填“化学腐蚀”或“电化学腐蚀”)。
(3)铁钉发生电化学腐蚀的负极反应式为:____________。
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是________________。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有_________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接
【答案】④ 电化学腐蚀 Fe-2e-=Fe2+ 铁接触空气和电解质溶液(铁与潮湿空气接触) ①②③
【解析】
(1)铁的腐蚀有化学腐蚀和电化学腐蚀两种,根据条件分析腐蚀类型,判断反应快慢;
(2)注意分析能否形成原电池条件来判断腐蚀的类型;
(3)负极上发生氧化反应,正极发生还原反应,以此来判断并书写电极反应式;
(4)电化学腐蚀发生了原电池反应,从原电池的形成条件来判断;
(5)金属的防护措施有牺牲阳极的阴极保护法、外加电流的阴极保护法,另外还有电镀、喷镀、喷油漆等方法使金属与空气、水等物质隔离,以防止金属腐蚀。
(1)①在干燥空气中难以腐蚀,②隔绝空气也难以腐蚀,③④发生电化学腐蚀,但④中电解质溶液离子浓度大,导电性强,电化学腐蚀速率快,故答案为:④;
(2)③中蒸馏水溶解氧气,能发生电化学腐蚀,故答案为:电化学腐蚀;
(3)反应中铁是负极,发生氧化反应,生成Fe2+,故答案为:Fe-2e-=Fe2+;
(4)电化学腐蚀的发生了原电池反应,从原电池的形成条件来判断:有两个活泼性不同的电极、电解质溶液、闭合回路,金属腐蚀时还有有空气,故答案为:铁接触空气和电解质溶液(铁与潮湿空气接触);
(5)本题中①②为外加防护膜的保护法,可以隔绝空气,③中金属镁比铁活泼,属于牺牲阳极的阴极保护法(可理解为牺牲负极的正极保护法),④中加快了金属的腐蚀,故答案为:①②③。


科目:高中化学 来源: 题型:
【题目】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
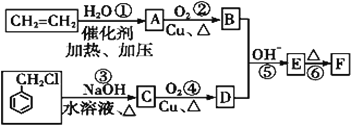
已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+![]()
![]()
![]()
请回答:
(1)D的名称为___。
(2)反应①~⑥中属于加成反应的是___(填序号)。
(3)写出反应③的化学方程式:____,其反应类型为____。
(4)在实验室里鉴定![]() 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是___(请按实验步骤操作的先后次序填写序号)。
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是___(请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 B.加NaOH溶液 C.加热 D.用稀硝酸酸化
(5)E的同分异构体有多种,其中之一甲属于酯类。甲可由H(已知H的相对分子量为32)和芳香酸G制得,则甲的结构共有___种。
(6)根据已有知识并结合相关信息,写出以乙烯为原料制备CH3CH=CHCHO的合成路线流程图(无机试剂任选)。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表前四周期的部分元素。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是____________,属于过渡元素的是_____________(该空用字母表示)。
(2)G元素原子结构示意图为___________。K元素简单离子结构示意图为__________。
(3)D、G、I、L简单离子半径大小顺序是________________。(用离子符号表示)
(4)C、D、H的气态氢化物的稳定性大小顺序是_______________。(用分子式表示)
(5)表中所给元素的最高价氧化物水化物中碱性最强的是_________。(填化学式)
(6)E、F、G简单离子的氧化性大小顺序是________________。(用离子符号表示)
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式________________。
(8)I的某种氧化物和J单质的水溶液发生反应的方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,下列叙述正确的是( )
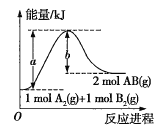
A.该反应是放热反应
B.由图可知,1molA2(g)和1molB2(g)反应生成2molAB(g)放出bkJ热量
C.由图可知,1molA2(g)和1molB2(g)反应生成2molAB(g)吸收bkJ热量
D.由图可知,1molA2(g)和1molB2(g)反应生成2molAB(g)吸收(a-b)kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A.X、Y、Z、W的原子半径依次减小
B.W与X元素的单质在常温下不反应
C.W的气态氢化物的沸点一定低于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一种钯催化的交叉偶联反应可以表示为:
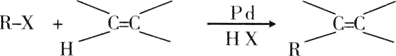
硝基还原为氨基: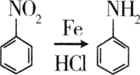
下面是利用钯催化的交叉偶联反应,以烯烃A(含两个甲基)与苯为原料合成L(相对质量不超过200)的过程,其中F在浓硫酸作用下可以发生两种不同的反应分别形成H和G。
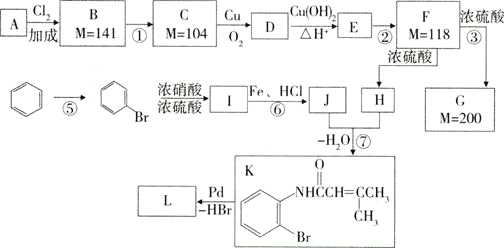
(1)写出反应的反应类型:④___⑥___。
(2)写出反应需要的无机反应物、反应条件:①___⑤___;
(3)J中所含官能团的名称__,__。
(4)根据要求完成下列两个空格:
用系统命名法给物质A命名:__;写出物质L的结构简式:__。
(5)写出下列反应的化学方程式:
C→D:___。
D与新制的Cu(OH)2__。
F→G:___。
(6)H有多种同分异构体,请写出一种符合下列条件的结构简式:__。
ⅰ.能发生水解反应
ⅱ.分子中只含有两个甲基
ⅲ.不含环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。 合成氨反应中有关化学键键能数据如下表:
化学键 | H—H | N≡N | N—H |
E/ kJmol﹣1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea=508 kJmol﹣1,则氨分解反应:2NH3(g)
2NH3(g)的活化能Ea=508 kJmol﹣1,则氨分解反应:2NH3(g)![]() N2(g)+3H2(g)的活化能Ea=_____。
N2(g)+3H2(g)的活化能Ea=_____。
②下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。

③依据温度对合成氨反应的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_______________。

(2)选择性催化还原脱硝技术(SCr)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
①SCr脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。
4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。

②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
③直接电解吸收也被用于脱硝。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的结构简式为![]() 。化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基。请完成下列问题。
。化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基。请完成下列问题。
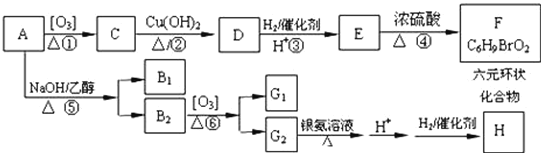
已知:![]()
(1)B1的结构简式为___,G2所含官能团为___。
(2)⑤的反应类型是___。
(3)反应④的化学方程式:___。
(4)写出C与新制Cu(OH)2反应的方程式:___。
(5)一定条件下H能够生成高分子化合物,写出反应的方程式___。
(6)符合下列条件的E的同分异构体共有___种;写出其中一个的结构简式为___。
①含有三个甲基;②与E所含官能团相同;③-OH和-Br不连在同一个碳原子上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com