
【题目】(Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15, 则此时 V正 V逆(填“ > ”、“=”或“<”)。
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。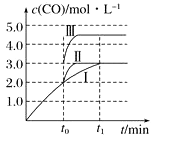
(3)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下, 将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。
(4)(Ⅱ)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
①常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
②称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.25mol·L-1 NaOH 溶液至20mL时,溶液由无色变为浅红色。第二份溶液滴加0.10 mol·L-1 酸性KMnO4溶液至16mL时反应完全。则原试样中H2C2O4·2H2O的的质量分数为 。
【答案】
(1)K1·K2;>
(2)加入催化剂;将容器的体积(快速)压缩至2L
(3)![]() ×10-7
×10-7
(4)c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-)> c(OH-);21%
【解析】(Ⅰ)(1)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2 , 结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,在500℃、2L的密闭容器中,进行反应③,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,Q= ![]() =0.87<K=2.5,反应正向进行,V正>V逆;
=0.87<K=2.5,反应正向进行,V正>V逆;
(2)图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变的,是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件当曲线Ⅰ变为曲线Ⅲ时,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
(3)通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K= ![]() =
= ![]() ×10-7L/mol;
×10-7L/mol;
(4)①向10mL 0.01molL-1的H2C2O4溶液滴加10mL 0.01molL-1NaOH溶液,草酸与氢氧化钠恰好反应生成草酸氢钠,由于草酸氢钠溶液显示酸性,则HC2O4-的电离程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氢离子来自水的电离和HC2O4-的电离,则c(H+)>c(C2O42-),HC2O4-的水解程度较小,则c(HC2O4-)>c(C2O42-),所以溶液中各离子浓度大小为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
②氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4 , 滴加0.10mol/L 酸性KMnO4溶液至16mL时反应完全,即消耗高锰酸根离子0.10mol/L×0.016L=0.0016mol,所以该溶液中还原剂的物质的量为: ![]() mol=4×10-3mol,20mL 0.25mol/L的氢氧化钠溶液中含有氢氧化钠的物质的量为:0.25mol/L×0.02L=5×10-3mol,设原样品中含有H2C2O42H2O的物质的量为x,含有KHC2O4的物质的量为y,则:2x+y=5×10-3mol、x+y=4×10-3mol,
mol=4×10-3mol,20mL 0.25mol/L的氢氧化钠溶液中含有氢氧化钠的物质的量为:0.25mol/L×0.02L=5×10-3mol,设原样品中含有H2C2O42H2O的物质的量为x,含有KHC2O4的物质的量为y,则:2x+y=5×10-3mol、x+y=4×10-3mol,
解得:x=10-3mol、y=3×10-3mol,原样品中含有H2C2O42H2O物质的量为:10-3mol× ![]() =0.01mol,
=0.01mol,
所以原试样中H2C2O42H2O的质量分数为: ![]() ×100%=21%。
×100%=21%。
故答案为:(1)K1·K2;>;(2)加入催化剂;将容器的体积(快速)压缩至2L;(3)![]() ;(4)c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-)> c(OH-);21%
;(4)c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-)> c(OH-);21%
(1)由盖斯定律确定三个反应间的关系,从而确定三个平衡常数的关系;计算某时刻的Q,再与平衡常数K比较,确定反应进行的方向,从而得出正逆反应速率的大小;
(2)根据影响平衡移动的因素分析判断;
(3)先根据反应确定溶液中所含微粒的浓度,再结合电离平衡常数的计算公式进行计算;
(4)混合后所得溶液中溶质为NaHC2O4 , 显酸性,则电离大于水解,据此分析溶液中离子浓度大小;
根据消耗高锰酸钾和NaOH的量,确定所取溶液中H2C2O4的量, 从而计算其质量分数。


科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活和社会可持续发展密切相关,下列说法正确的是( )
A.煤的干馏是物理变化
B.为防止食品氧化变质,包装袋中常放入生石灰
C.淀粉遇碘变蓝,可用米汤检验加碘盐中是否加碘
D.推广使用新能源汽车能够减少不可再生资源的消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属冶炼的说法正确的是( )
A.由于铝的活泼性强,故工业上采用电解熔融A1C13的方法生产单质铝
B.将钠投入氯化镁饱和溶液中,可置换出镁单质
C.冶炼金属的方法,本质上是由金属的活泼性决定的
D.铝热反应需要在高温下进行,是一个典型的吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴化钾、碘化钾的混合溶液中通入足量的氯气,再加热将溶液蒸干并灼烧,最后残留的物质是( )
A.KClB.KCl、I2C.KCl、KBrD.KCl、Br2、I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国南海海域是全球范围内石油储量与可开采储量较丰富、开采潜力较大的地方,有“第二个波斯湾”之称.下列关于石油的说法正确的是( )
A.石油属于可再生矿物能源
B.石油只含有碳、氢、氧三种元素
C.石油裂化的主要目的是提高轻质液体燃料的产量和质量
D.石油分馏的各馏分均是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酿造厂生产的“老谢琼醋”是一种优质琼醋。某高二年级研究性学习小组,运用酸碱中和滴定的原理对“老谢琼醋”进行了定量分析,以测定其中的酸(全部以醋酸CH3COOH计)的含量:用酸式滴定管取10.00 mL这种琼醋,置于已知质量的小烧杯中称得其质量为12.5 g,再用100 mL容量瓶稀释至100 mL,滴定时每次取20.00 mL于锥形瓶中,而选用的标准溶液是0.112 5 mol/L NaOH溶液,以及合适的指示剂。读取的数据记录如下,其中第3次滴定的读数请从下图中读取。
滴定次数 | 用去NaOH溶液的体积 | ||
滴定前刻度 | 滴定后刻度 | 体积(mL) | |
1 | 3.20 | 22.48 | |
2 | 1.23 | 20.55 | |
3 | — | — | |
(1)请把有关数据填入表中所有空格里。
(2)琼醋样品从取出、称量、稀释到取液过程中,下列仪器水洗后不应再用相应琼醋润洗的仪器是()
A.酸式滴定管
B.烧杯
C.100 mL容量瓶
D.锥形瓶
(3)滴定时在锥形瓶底垫一张白纸的作用。
(4)滴定操作时,左手应 , 观察滴定管里液面的高度时应注意。
(5)选用的合适指示剂是 , 变色情况是。
(6)计算稀释后容量瓶中醋酸的物质的量浓度。
(7)计算“老谢琼醋”中醋酸的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分为MnO2 , 含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。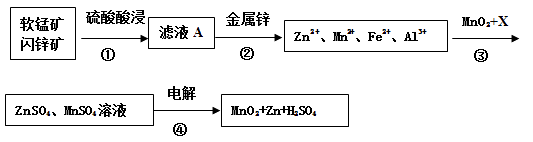
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是。
(3)步骤③中MnO2的作用是 ,另外一种物质X可以是 。
A.ZnO B.MgCO3 C. MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2 , 它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式。
(5)已知:HCN的电离常数K=4.9×10-10 , H2S的电离常数K1=1.3×10―7 , K2=7.0×10―15 , 向NaCN溶液中通入少量的H2S气体,反应的离子方程式为。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=。[已知:Ksp(MnS)=1.4×10―15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为10 mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是( )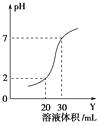
A | B | C | D | |
X浓度/mol·L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
Y浓度/mol·L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是
A.CaOB.SiO2C.Al2O3D.Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com