
【题目】进行化学实验时应强化安全意识。下列做法正确的是
A.浓硫酸溅到皮肤上时立即用浓氢氧化钠溶液冲洗
B.用试管加热碳酸氢钠固体时使试管口向上倾斜
C.点燃可燃性气体如H2前需检验气体的纯度
D.金属钠着火时用水灭火
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.摩尔既是物质的量的单位,又是粒子的数量单位
B.2 mol O2的摩尔质量是64 g/mol
C.摩尔质量在数值上与1mol该物质的质量相等
D.1 mol SO2中含有2 mol O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使K2S溶液中 ![]() 的比值变小,可加入的物质是( ) ①适量HCl(g)
的比值变小,可加入的物质是( ) ①适量HCl(g)
②适量NaOH(s)
③适量KOH(s)
④适量NaHS(s)
⑤适量的水.
A.②④
B.①②⑤
C.③④⑤
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是 ( )
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的产量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b。
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,前者大。
④若将适量CO2 通入0.1 mol/LNa2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+ c(HCO3ˉ)= 0.1 mol/L
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
A.①②④⑤
B.②④⑤
C.②⑤
D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科学家中,为化学理论做出重大贡献的是
A. 徐光宪(创立稀土萃取理论) B. 屠呦呦(创制新的抗疟疾药)
C. 袁隆平(培育杂交水稻) D. 钱学森
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As、Ga、Cr等元素化合物种类繁多,具有重要的研究价值和应用价值。请回答下列问题:
(1)N元素与Al、Si等元素在一定条件下生成AlN和Si3N4 , 实验测得二者在真空条件下的稳定存在的最高温度2200℃和1900℃,硬度类似金刚石,常用作耐高温和耐磨材料。请推测它们属于晶体类型。
(2)PCl3和PCl5是磷元素形成的两种重要化合物,请根据价电子互斥理论推测PCl3的空间构型。
(3)As的核外电子排布式中不同类型(s、p、d、f等)的电子比是 。
(4)Cr元素价电子排布式为。
(5)砷化镓以第三代半导体著称,性能比硅更优良,广泛用于雷达、电子计算机、人造卫星、宇宙飞船等尖端技术中已知砷化镓的晶胞结构如右图所示,则砷化镓晶胞结构与NaCl晶胞(填“相同”或“不同”)。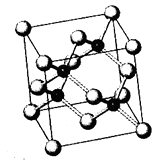
(6)根据As和Ga在元素周期表中的位置判断,第一电离能AsGa(填“<”“>”或“=”)。
(7)(CH3)3Ga中镓原子的杂化类型为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的3个密闭容器中发生反应3A(g)+B(g)xC(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3mol A、2mol B | 6mol A、4mol B | 2mol C |
到达平衡的时间(min) | 5 | 8 | |
A的浓度(mol/L) | c1 | c2 | |
C的体积分数 | w1 | w3 | |
混合气体密度(g/L) | ρ1 | ρ2 |
下列说法正确的是( )
A.若x<4,则2c1<c2
B.若w3=w1 , 可断定x=4
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲中反应从开始到达平衡平均速率为v(A)=0.3 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
(1)按电子排布,Q元素在周期表中属区.
(2)第一电离能YZ,电负性YZ(填“>”,“=”或“<”).
(3)W与Z形成的常见化合物有W2Z、W2Z2 , W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6…,W2Z分子中Z原子的杂化类型为 , YW3分子的立体构型为 , YW3极易溶于W2Z的主要原因有 .
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 .
(5)Q+与Y3﹣形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏伽德罗常数用NA 表示,则晶体的密度为gcm﹣3 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com