
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是 ( )
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的产量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b。
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,前者大。
④若将适量CO2 通入0.1 mol/LNa2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+ c(HCO3ˉ)= 0.1 mol/L
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
A.①②④⑤
B.②④⑤
C.②⑤
D.①③⑤
【答案】D
【解析】①化学平衡向正反应方向移动时,生成物的产量一定增加,正确;
②醋酸是弱酸,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后,醋酸过量,溶液显酸性,抑制水的电离;等浓度的盐酸与NaOH溶液等体积混合后恰好反应生成氯化钠,对水的电离无影响,水的电离程度a<b,错误;
③常温下,AgCl在同物质的量浓度的氨水中反应生成二氨合银离子,溶解度较大,在NaCl溶液中,氯离子浓度增大,使氯化银的溶解平衡向左移动,溶解度减小,正确;
④将适量CO2 通入0.1 mol/LNa2CO3溶液中至溶液恰好呈中性,溶液中的氢离子浓度等于氢氧根离子浓度,根据电荷守恒,2c(CO32-)+ c(HCO3ˉ)= c(Na+)=0.2mol/L,错误;
⑤醋酸的电离方程式为CH3COOH ![]() CH3COO-+H+ , 醋酸电离平衡常数为Ka=
CH3COO-+H+ , 醋酸电离平衡常数为Ka= ![]() ;醋酸根水解平衡常数为Kh=
;醋酸根水解平衡常数为Kh= ![]() ;则Ka·Kh=
;则Ka·Kh= ![]() ×
× ![]() = c(H+)c(OH-) = Kw , 正确;
= c(H+)c(OH-) = Kw , 正确;
故答案为:D①平衡正移,则反应物的量减少,生成物的量增多;
②pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后,由于醋酸是弱酸,所得溶液中含有大量的醋酸分子,溶液显酸性;
③AgCl能与氨水反应,生成二氨合银离子,增大AgCl的溶解度;
④溶液呈现中性,则存在电荷守恒2c(CO32-)+ c(HCO3ˉ)= c(Na+);
⑤根据醋酸电离平衡常数、醋酸根离子水解平衡常数、水电离平衡常数的表达式,找出三者之间的关系。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】下列表格中各项分类都正确的一组是( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | CuSO45H2O | 液态KNO3 | 蔗糖 |
B | CaO | 海水 | 铜 | 酒精 |
C | 液氯 | 铝合金 | AgCl | CO2 |
D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,完全正确的一组是( )
①用试管夹夹持试管时,试管夹从试管的底部向上套,夹在试管的中上部 ②给盛有液体超过试管容积![]() 的试管加热 ③把鼻孔靠近容器口去闻气体的气味 ④将试管平放,用纸槽向试管里送入固体粉末,然后使试管竖立起来 ⑤取用放在细口瓶里的液体时,取下瓶塞倒放在桌面上,倾倒液体时,标签向着地面 ⑥将烧瓶放在桌面上,再将塞子用力塞上 ⑦用坩埚钳夹持加热后的蒸发皿 ⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒进盛有浓硫酸的量筒中 ⑩检验装置的气密性时,把导管的一端浸入水中,用手掌握住容器或用酒精灯微热
的试管加热 ③把鼻孔靠近容器口去闻气体的气味 ④将试管平放,用纸槽向试管里送入固体粉末,然后使试管竖立起来 ⑤取用放在细口瓶里的液体时,取下瓶塞倒放在桌面上,倾倒液体时,标签向着地面 ⑥将烧瓶放在桌面上,再将塞子用力塞上 ⑦用坩埚钳夹持加热后的蒸发皿 ⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒进盛有浓硫酸的量筒中 ⑩检验装置的气密性时,把导管的一端浸入水中,用手掌握住容器或用酒精灯微热
A.①④⑦⑩
B.①④⑤⑦⑩
C.①④⑤⑦⑧⑨
D.④⑤⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW , 该温度下,将浓度为a mol/L的一元酸HA与b mol/L一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.混合溶液的pH=7
B.混合溶液中,c(H+)= ![]() mol/L
mol/L
C.a=b
D.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质鉴别的实验方法正确的是
A.用溴水鉴别裂化汽油和植物油B.用银氨溶液鉴别甲酸甲酯和甲酸乙酯
C.用碳酸氢钠鉴别苯甲酸和苯甲醇D.用水鉴别四氯化碳和溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验时应强化安全意识。下列做法正确的是
A.浓硫酸溅到皮肤上时立即用浓氢氧化钠溶液冲洗
B.用试管加热碳酸氢钠固体时使试管口向上倾斜
C.点燃可燃性气体如H2前需检验气体的纯度
D.金属钠着火时用水灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。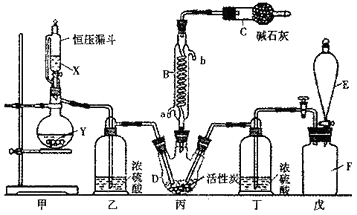
(1)仪器E的名称是 , 由B的使用可知SO2与氯气之间的反应属于(填“放”或“吸”)热反应,B处反应管冷却水应从 (填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是。
(2)试剂X、Y的组合最好是。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是 .
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为 %(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
(1)请写出:D基态原子的价层电子排图:; F 基态原子的外围电子排布式: .
(2)下列说法错误的是 .
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2 .
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似.
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键.
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点.向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成(F(X)4)2+ , 该离子的结构式为(用元素符号表示).
(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有 . 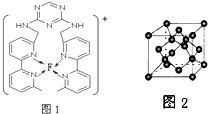
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为 .
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com