
| ��c |
| ��t |
| ��c |
| ��t |
| 1.2mol/L |
| 2min |
| ||
| 2min |
| 1.6 |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����;�����մﵽƽ��ʱ����ϵ�ڻ���������ְٷ������ͬ |
| B����;�����մﵽƽ��ʱ����ϵ�ڻ���������ְٷ���ɲ�ͬ |
| C���ﵽƽ��ʱ��;��I�ķ�Ӧ���ʵ���;����ķ�Ӧ���� |
| D���ﵽƽ��ʱ��;��I���û�������ܶȵ���;�������û�����ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
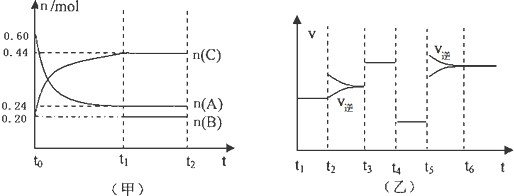
| A����t1=15s����t0-t1����AŨ�ȱ仯��ʾ�ķ�Ӧ����v��A��Ϊ0.006mol/��L?s�� |
| B��B����ʼ���ʵ���Ϊ0.08mol |
| C����t2-t3�θı������������A��Ũ�ȣ���ƽ��ʱC������������ |
| D���÷�ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Һ��ӣ�NH4��2SO4��Һ���ᴿ������ |
| B���ڶ����м�������ʯ����ʹ��������Ϊ���� |
| C���¶�Խ�ߣ�ø��ijЩ��ѧ��Ӧ�Ĵ�Ч��Խ�� |
| D������ij��֯��ɷ��ǵ���˿��������˿���ɲ�����������ζ�ķ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com