
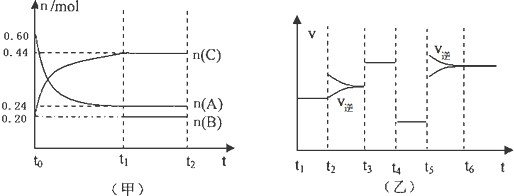
| A、若t1=15s,则t0-t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L?s) |
| B、B的起始物质的量为0.08mol |
| C、若t2-t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变大 |
| D、该反应为放热反应 |
| 0.09molL |
| 15s |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 |
| n(PCl5) | 4 | 2.8 | 2 | 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度能加快生成尿素的速率 |
| B、增大压强能使反应有利于向生物方向移动 |
| C、氨碳比越大越有利于尿素的生成 |
| D、若氨能与反应生成的水结合生成一水合氨,则能促使平衡向生成尿素方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力而自发进行的过程,其体系的能量一定是由高能状态转变为低能状态 |
| D、要判断反应进行的方向,必须综合考虑体系的焓变和熵变. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+6 | B、+3 | C、+2 | D、0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com