


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
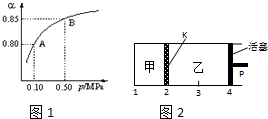 硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食醋除去水壶内的水垢:CaCO3+2H+=Ca2++CO2↑+H2O | ||||
| B、表示HS-电离的方程式为:HS-+H2O?S2-+H3O+ | ||||
C、用两个铁电极电解氢氧化钠溶液:2H2O
| ||||
| D、表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1)△H=+571.6 KJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com