
【题目】已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
A. 所得溶液中的c(H+)=1.0×10-13mol·L-1
B. 所得溶液中由水电离产生的c(OH-)=1.0×10-13mol·L-1
C. 所加的烧碱溶液pH=13
D. 所得溶液中的c(Mg2+)=5.6×10-10mol·L-1
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为__;常温下丁溶液pH___7(填“>”“<”或“=”),用离子方程式解释原因____________;
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。回答下列问题:
①A在周期表中位置为___________;
②向丁的水溶液中滴入紫色石蕊试液,现象为_____________________;
③写出加热条件下上述生成丙的化学方程式__________________;
④向MCl2的溶液中通入丁,生成白色MCl沉淀,写出该反应的离子方程式__________;
⑤已知常温下弱电解质的电离平衡常数如下:一水合氨Kb=1.8×10-5,戊:Ka1=1.3×10-2, Ka2 = 6.3×10 -8。若一水合氨与丁恰好完全反应生成正盐,则浓度为0.1 mol/L的该正盐溶液呈____性(填“酸”或“碱”或“中”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____2(填“>”“<”或“=”)。
____2(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() 1-丁醇
1-丁醇
CO的制备原理:HCOOH![]() CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
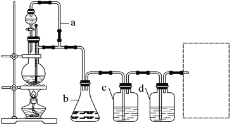
请填写下列空白:
(1)1-丁醇的结构简式:______,HCOOH的名称______,浓硫酸在制备CO中体现的性质有____(填“脱水性”、“吸水性”、“强氧化性”或“酸性”);
(2)若用图装置制备干燥纯净的CO,装置中a和b的作用分别是______,______;温度计的作用是_____________,分液漏斗、c和d中盛装的试剂分别是____,____,____。若用图装置制备H2,在虚线框内画出收集干燥H2的装置图______;
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂(试剂足量)检验这四种气体,混合气体通过试剂的顺序是____________(填序号);
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是____________;
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品。为纯化1丁醇,该小组查阅文献得知。①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34 ℃,1丁醇118 ℃,并设计出如下提纯路线:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
操作1为_______________,操作2______________,若利用图1装置中已有的仪器实现操作3,还必须增加的实验仪器有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,CrO42和Cr2O72在溶液中可相互转化,K2Cr2O7溶液中存在平衡:Cr2O![]() (橙色)+H2O
(橙色)+H2O![]() 2CrO
2CrO![]() (黄色)+2H+ 回答下列问题:
(黄色)+2H+ 回答下列问题:
(1)CrO42和Cr2O72在溶液中可相互转化,用K2Cr2O7溶液进行下列实验:

结合实验,下列说法正确的是________
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O![]() 被C2H5OH氧化
被C2H5OH氧化
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
(2)室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。
②根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_____0 (填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl 恰好完全沉淀(浓度等于1.0×105mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列有关该同学对实验原理的解释和所得结论的叙述不正确的是( )
A. 氧化性:ClO->I2>SO42—
B. 蓝色消失的原因是Na2SO3溶液具有漂白性
C. 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2使淀粉变蓝
D. 若将Na2SO3溶液加入氯水中,氯水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含的少量杂质(括号内为杂质),所用除杂试剂正确的是
A.NaCl溶液(I2)用CCl4B.硝酸银溶液(硝酸铜)加铜粉
C.Na2CO3(NaHCO3)用HCl溶液D.CO2(HCl)用NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com