
| A、1mol碳正离子(CH5+)所含的质子数为11NA |
| B、15g乙烷分子中所含非极性共价键数为3NA |
| C、标准状况下,22.4L苯完全燃烧所消耗的氧气分子数为7.5NA |
| D、1L 0.1mol/L乙酸溶液中H+数为0.1NA |
| m |
| M |
| m |
| M |
| 15g |
| 30g/mol |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、两个反应均为氧化还原反应 |
| B、CO2与SO2可以用澄清石灰水鉴别 |
| C、CO2分子中各原子最外层均为8电子稳定结构 |
| D、相同条件下:2CO(g)+SO2(g)═S(g)+2CO2(g)△H=-270kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、NO3-、Cl-、Na+ |
| B、Na+、Ba2+、Mg2+、NO3- |
| C、OH-、K+、HCO3-、Ba2+ |
| D、H+、CO32-、K+、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,使用pH计测定浓度均为0.1mol/L NaClO、CH3COONa的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 检验蔗糖水解产物具有还原性 |
| C | 向新生成的AgCl悬浊液中滴入KI溶液 | 研究沉淀的转化 |
| D | 室温下,向两支装有同体积同浓度过氧化氢溶液的试管中,分别加入3滴同浓度的氯化铜、氯化铁溶液 | 研究催化剂对反应速率的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X、Y元素的金属性 X<Y |
| B、X、Y、Z、W的单质都具有可燃性 |
| C、Y的最高价氧化物对应的水化物能溶于稀氨水 |
| D、一定条件下,W单质可以与Z的氢化物反应生成ZW |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数小于0.1 NA |
| B、常温常压下,8.8gCO2和N2O混合物中所含有的原子数为0.6NA |
| C、室温下,8 g甲烷含有共价键数为2 NA |
| D、标准状况下,27g铝与22.4L的氯气充分反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 粒子代码 | a | e | H |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
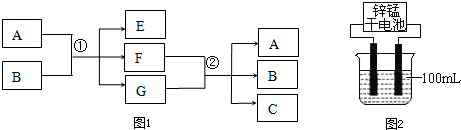
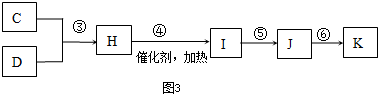
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com