
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法错误的是
已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)

A.碳棒上发生的电极反应:4OH—- 4e—= O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高二上学期期末化学试卷(解析版) 题型:选择题
25 ℃、101 kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是
A.2H2O(l) ===2H2(g)+O2(g); ΔH =+571.6 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g); ΔH =-571.6 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l); ΔH =+571.6 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l); ΔH =-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:实验题
电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液。由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:
(2)I中加入过量Fe粉 ,然后过滤,滤渣中有Cu、Fe,为了得到纯净铜,不产生新的杂质,试剂A应是HCl。.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl36H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是 。
(2)试剂A是 。
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是 。
a.检验Cl2的存在 b检验Fe3+的存在 c.检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是 (填字母)。
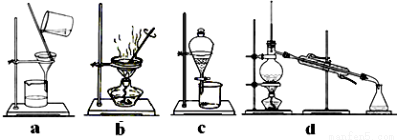
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列做法会对人体健康造成较大危害的是
A.用大量SO2漂白银耳
B.用小苏打(NaHCO3)焙制糕点
C.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D.用消毒液(有效成分NaClO)对餐具进行杀菌消毒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:填空题
(18分)某无机化合物A由X、Y两种元素组成。在空气中充分灼烧得到含X元素的8g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得46.6g固体。
(1)写出X在元素周期表中的位置 ,写出Y2-的结构示意图
写出B的化学式
(2)写出气体C通入H2O2中反应的离子方程式
(3)将A溶于D的稀溶液中得到E,并产生一种单质固体和一种气体,写出该反应的化学方程式
(4)将化合物E固体隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的分子式是 ;有同学认为该分解反应得到的固体产物中除B外,还可能会有含X元素的低价态物质,请判断该同学的观点是否合理 理由是
(5)请设计实验证明E完全分解后的固体产物中是否含有X元素的低价态化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。

已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。

先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
已知短周期元素A、B、C、D最高价氧化物对应的水化物分别为X、Y、Z、W。A是短周期中原子半径最大的元素。常温下X、Z、W均可与Y反应,0.1 mol/L X、Z、W溶液的pH如图所示。(横坐标表示X,Z,W对应的A,C,D的原子序数)

下列说法正确的是
A.B的离子半径大于A的离子半径
B.C的氢化物的稳定性大于D的氢化物的稳定性
C.X、W两物质含有的化学键类型相同
D.B原子的电子层数与最外层电子数相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列描述中正确的是
A.CS2为直线形的极性分子
B.NH4+中N-H键能、键长和键角均相同
C.AB2为V形,则A一定为sp2杂化
D.SiF4和SO的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为
A.0.2mol B.0.6mol
C.0.8mol D.1.0mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com