
【题目】下列有机反应方程式书写正确的是( )
A.乙烯与溴水反应:CH2=CH2+Br2→CH3CHBr2
B.苯的硝化反应:![]() +HNO3
+HNO3![]()
 +H2O
+H2O
C.乙醇的催化氧化:CH3CH2OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
D.乙酸与乙醇发生酯化反应:CH3COOH+HOCH2CH3![]() CH3COOCH2CH3
CH3COOCH2CH3
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中存在平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )
Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是( )
①升高温度,平衡逆向移动 ②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下,向溶液中加入CaO,溶液的pH升高
⑤向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
A.①⑥B.①⑤⑥C.②③④⑥D.①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g)![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
Ⅱ.3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
则CO与H2合成气态甲醇的热化学方程式为___________________________________
(2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500℃时,研究了n(H2):n(CO)分别为2:1、5:2时CO的转化率变化情况(如图1所示),则图中表示n(H2):n(CO)=2:1的变化曲线为___________(填“曲线a”或“曲线b”),原因是_______________________________。
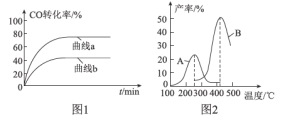
(3)某科研小组向密闭容器中充入一定量的CO和H2合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是____________(填选项字母)。
a.使用催化剂A能加快相关化学反应速率,但催化剂A并未参与反应
b.在恒温恒压的平衡体系中充入氩气,CH3OH的产率降低
c.当2v(CO)正=v(H2)逆时,反应达到平衡状态
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。

若甲容器平衡后气体的压强为开始时的![]() ,则该温度下,该反应的平衡常数K=______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
,则该温度下,该反应的平衡常数K=______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
(5)CO与日常生产生活相关。
①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为__________________。
②碳酸二甲醋[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图3所示:
2(CH3O)2CO+2H2O,装置如图3所示:
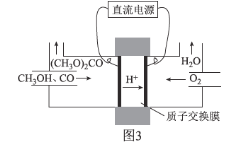
写出阳极的电极反应式:________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO 等)湿法制取金属锌的流程如图所示,回答下列问题。

已知:Fe的活泼性强于Ni。
(1)ZnFe2O4可写成ZnOFe2O3,则ZnFe2O4与H2SO4反应的化学方程式___。
(2)“净化Ⅰ”操作分为两步:
①将溶液中少量的 Fe2+氧化,下列试剂中可选用的是_____(填字母标号)。
A.新制氯水 B.30 % H2O2溶液 C.FeC13溶液 D.KMnO4溶液
②加入ZnO,调节溶液pH为3.3~6.7;加热到60℃左右并不断搅拌,加热搅拌主要目的是___。
(3)“净化Ⅰ”生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____。
(4)“净化Ⅱ”中加入过量Zn的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废金属屑中主要成分为Cu、Fe和Al(含有少量Al2O3和Fe2O3),某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
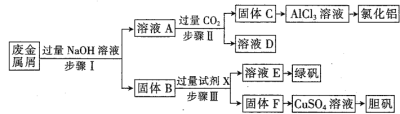
请回答:
(1)胆矾的化学式为___________________。
(2)溶液E为绿色溶液,则试剂X是______________。
(3)步骤I,首先加入温热NaOH溶液,作用是_________;-段时间后,再分批加入常温NaOH溶液,原因是___________。
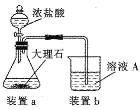
(4)在步骤II时,用如图装置制取CO2并通入溶液A中。-段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在a和b间加-个盛有饱和_________溶液的洗气瓶。
(5)保存FeSO4溶液时,需要滴加少量硫酸溶液,再加入适量_______(填化学式),防止变质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
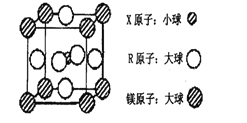
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着时代的发展,绿色环保理念越来越受到大家的认同,变废为宝是我们每一位公民应该养成的意识。某同学尝试用废旧的铝制易拉罐作为原材料、采用“氢氧化铝法”制取明矾晶体并进行一系列的性质探究。
制取明矾晶体主要涉及到以下四个步骤:
第一步:铝制品的溶解。取一定量铝制品,置于250mL锥形瓶中,加入一定浓度和体积的强碱溶液,水浴加热(约93℃),待反应完全后(不再有氢气生成),趁热减压抽滤,收集滤液于250mL烧杯中;
第二步:氢氧化铝沉淀的生成。将滤液重新置于水浴锅中,用3 mol/L H2SO4调节滤液pH至8~9,得到不溶性白色絮凝状Al(OH)3,减压抽滤得到沉淀;
第三步:硫酸铝溶液的生成。将沉淀转移至250mL烧杯中,边加热边滴入一定浓度和体积的H2SO4溶液;
第四步:硫酸铝钾溶液的形成。待沉淀全部溶解后加入一定量的固体K2SO4,将得到的饱和澄清溶液冷却降温直至晶体全部析出,减压抽滤、洗涤、抽干,获得产品明矾晶体[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列问题:
(1)第一步铝的溶解过程中涉及到的主要反应的离子方程式为__________________________
(2)为了加快铝制品的溶解,应该对铝制品进行怎样的预处理:________________________
(3)第四步操作中,为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的___(填选项字母)进行洗涤,实验效果最佳。
A.乙醇 B.饱和K2SO4溶液 C.蒸馏水 D.1:1乙醇水溶液
(4)为了测定所得明矾晶体的纯度,进行如下实验操作:准确称取明矾晶体试样4.0g于烧杯中,加入50mL 1mol/L盐酸进行溶解,将上述溶液转移至100mL容量瓶中,稀释至刻度线,摇匀;移取25.00 mL溶液干250 mL锥形瓶中,加入30 mL 0.10mol/L EDTA-2Na标准溶液,再滴加几滴2D二甲酚橙,此时溶液呈黄色;经过后续一系列操作,最终用0.20 mol/L锌标准溶液滴定至溶液由黄色变为紫红色,达到滴定终点时,共消耗5.00 mL锌标准溶液。滴定原理为H2Y2-+Al3+→AlY-+2H+,H2Y2-(过量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na标准溶液离子)。则所得明矾晶体的纯度为_________%。
(5)明矾除了可以用作人们熟悉的净水剂之外,还常用作部分食品的膨松剂,例如油条(饼)的制作过程需要加入一定量的明矾,请简述明矾在面食制作过程作膨松剂的原理:_______
(6)为了探究明矾晶体的结晶水数目及分解产物,在N2气流中进行热分解实验,得到明矾晶体的热分解曲线如图所示(TG%代表的是分解后剩余固体质量占样品原始质量的百分率,失重百分率=![]() ×100%):
×100%):
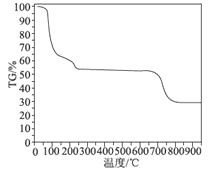
根据TG曲线出现的平台及失重百分率,30~270℃范围内,失重率约为45.57%,680~810℃范围内,失重百分率约为25.31%,总失重率约为70.88%,请分别写出所涉及到30~270℃、680~810℃温度范围内这两个阶段的热分解方程式:___________、_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确且对应的△H的数值和意义与括号内表述相符的是( )
A. 2H2 (g) + O2 (g) = 2H2O (l) ΔH=-571.6 kJ/mol(燃烧热)
B. NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol(中和热)
C. H2O(g)=H2(g)+1/2 O2(g) ΔH=-242 kJ/mol (反应热)
D. C(s)+ O2 ( g )=CO2(g) ΔH=-393.5 kJ/mol(反应热)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com