
【题目】工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g)![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
Ⅱ.3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
则CO与H2合成气态甲醇的热化学方程式为___________________________________
(2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500℃时,研究了n(H2):n(CO)分别为2:1、5:2时CO的转化率变化情况(如图1所示),则图中表示n(H2):n(CO)=2:1的变化曲线为___________(填“曲线a”或“曲线b”),原因是_______________________________。
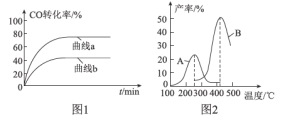
(3)某科研小组向密闭容器中充入一定量的CO和H2合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是____________(填选项字母)。
a.使用催化剂A能加快相关化学反应速率,但催化剂A并未参与反应
b.在恒温恒压的平衡体系中充入氩气,CH3OH的产率降低
c.当2v(CO)正=v(H2)逆时,反应达到平衡状态
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。

若甲容器平衡后气体的压强为开始时的![]() ,则该温度下,该反应的平衡常数K=______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
,则该温度下,该反应的平衡常数K=______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
(5)CO与日常生产生活相关。
①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为__________________。
②碳酸二甲醋[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图3所示:
2(CH3O)2CO+2H2O,装置如图3所示:
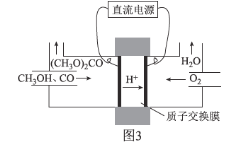
写出阳极的电极反应式:________________________________________
【答案】CO(g)+2H2(g)![]() CH3OH(g) △H=-90.1kJ/mol 曲线b H2的含量越低,CO的转化率越低 bc 0.25 1<c<2 CO+O2--2e-=CO2 2CH3OH+CO-2e-= (CH3O)2CO+2H+
CH3OH(g) △H=-90.1kJ/mol 曲线b H2的含量越低,CO的转化率越低 bc 0.25 1<c<2 CO+O2--2e-=CO2 2CH3OH+CO-2e-= (CH3O)2CO+2H+
【解析】
(1)根据盖斯定律解题;
(2)增加反应物浓度,平衡正向移动,增加的反应物转化率下降,其他反应物的转化率上升;
(3)催化剂可以同等程度加快反应速率,参加中间反应;根据平衡移动分析;
(4)利用三行式法计算k;根据等效平衡分析;
(5)根据负极氧化失电子,阳极氧化失电子分析。
(1)根据盖斯定律,(Ⅰ-Ⅱ)/3可得,CO(g)+2H2(g)![]() CH3OH(g) △H=-90.1kJ/mol;
CH3OH(g) △H=-90.1kJ/mol;
答案:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.1kJ/mol
CH3OH(g) △H=-90.1kJ/mol
(2) 因为增加反应物浓度,平衡正向移动,增加的反应物转化率下降,其他反应物的转化率上升,则n(H2)/n(CO)越小,CO的转化率越小,故曲线b表示n(H2)/n(CO)=2:1的变化曲线;
答案:曲线b H2的含量越低,CO的转化率越低
(3) a.催化剂参与相关化学反应,但化学反应前后,催化剂的质量和化学性质不变,故a不正确;
b.在恒温恒压的平衡体系中充入氩气,体积增大,平衡逆向移动,CH3OH的产率降低,故b正确;
c.当2v(CO)正=v(H2)逆时,反应达到平衡状态,故c正确;
答案:bc
(4)设一氧化碳的反应量为x,根据甲
CO(g)+ 2H2(g)![]() CH3OH(g)
CH3OH(g)
n(初)2mol 6mol 0mol
△n xmol 2xmol xmol
n(平)(2-x)mol (6-2x)mol xmol
根据![]() =
=![]() ,得x=1,则容器的容积为2L,平衡后c(CO)=0.5mol/L,c(H2)=2mol/L,c(CH3OH)=0.5mol/L,则K=
,得x=1,则容器的容积为2L,平衡后c(CO)=0.5mol/L,c(H2)=2mol/L,c(CH3OH)=0.5mol/L,则K=![]() =
=![]() 或0.25;要使平衡后乙容器与甲容器中相同组分的体积分数相等,甲、乙必为等效平衡,因为起始时要维持化学反应向逆反应方向进行,可以根据平衡时甲醇的物质的量为1mol,确定c的物质的量大于1;根据假设甲容器反应进行到底生成甲醇2mol,确定c的物质的量小于2,得出乙容器中c的取值范围为1<c<2;
或0.25;要使平衡后乙容器与甲容器中相同组分的体积分数相等,甲、乙必为等效平衡,因为起始时要维持化学反应向逆反应方向进行,可以根据平衡时甲醇的物质的量为1mol,确定c的物质的量大于1;根据假设甲容器反应进行到底生成甲醇2mol,确定c的物质的量小于2,得出乙容器中c的取值范围为1<c<2;
答案:![]() 或0.25 1<c<2
或0.25 1<c<2
(5)①由于电解质为金属氧化物,则负极CO发生氧化反应与O2-结合生成CO2,电极反应式为:CO+O2--2e-=CO2
②阳极氧化失电子,电极反应式为2CH3OH+CO-2e-= (CH3O)2CO+2H+;
答案:CO+O2--2e-=CO2 2CH3OH+CO-2e-= (CH3O)2CO+2H+


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的____极,发生的电极反应式为______; X电极上发生的电极反应为______;(填反应类型)
(3)外电路中的电子是从_______电极流向________电极。Ag+向_______ (填正极或负极)移动。
(4)当有1.6g铜溶解时,银棒增重_________________。
(5)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:H2+O2--2e-=H2O; B极:O2+4e-=2O2-。则A极是电池的______极;电子从该极____(填“流入”或“流出”),该电池的总反应为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质。
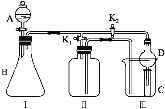
(1)打开K1关闭K2,可制取某些气体。甲同学认为装置Ⅰ可用于制取H2、NH3、O2,但装置Ⅱ只能收集H2、NH3,不能收集O2。其理由是_____。乙同学认为在不改动装置Ⅱ仪器的前提下,对装置Ⅱ进行适当改进,也可收集O2。你认为他的改进方法是_____。
(2)打开K2关闭K1,能比较一些物质的性质。丙同学设计实验比较氧化性:KClO3>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是______;仪器D在该装置中的作用是_______。在B装置中发生反应的离子方程式为______。丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是_____。
(3)实验室常用浓H2SO4与硝酸钠反应制取HNO3。下列装置中最适合制取HNO3的是_____。实验室里贮存浓硝酸的方法是_______。
a  b
b 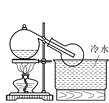 c
c 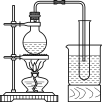 d
d 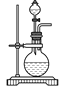
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1=1.1×10-5,Ka2=1.3×10-8。下列叙述正确的是
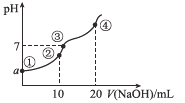
A.a近似等于3
B.点②处c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.点③处为H2X和NaOH中和反应的滴定终点
D.点④处c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取冰晶石(Na3AlF6)的化学方程式如下:![]()
完成下列填空:
(1)反应中四种元素对应的简单离子核外电子排布相同,请按离子半径从大到小的顺序排列这四种离子____,其中原子序数最大的元素原子核外有___种能量不同的电子,其最外层电子的电子云有____种不同的伸展方向。
(2)反应中有两种元素在元素周期表中位置相邻,能比较它们的金属性或非金属性强弱的事实是____(选填编号)。
a. 气态氢化物的稳定性 b. 最高价氧化物对应水化物的酸性
c. 单质与氢气反应的难易 d. 单质与同浓度酸发生反应的快慢
反应中两种金属元素,它们的最高价氧化物对应的水化物之间发生反应的离子方程式为_______。
(3)冰晶石在工业上可做电解氧化铝的助溶剂,此反应中若有0.6mol电子转移,则在____极可得金属铝的质量为_____克。
(4)工业上不采用电解氯化铝的方法而是采用电解氧化铝的方法获得铝单质的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式N2(g)+3H2(g)2NH3(g)+92kJ,下列有关图象和叙述中正确的是
A.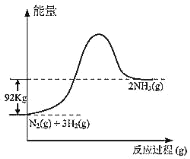
B.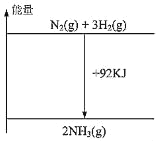
C.向密闭容器中通入1mol氮气和3mol氢气发生反应放出92kJ的热量
D.形成1mol氮氮键和3mol氢氢键所放出的能量比拆开2mol氮氢键所吸收的能量多92kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com