
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1=1.1×10-5,Ka2=1.3×10-8。下列叙述正确的是
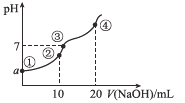
A.a近似等于3
B.点②处c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.点③处为H2X和NaOH中和反应的滴定终点
D.点④处c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
【答案】A
【解析】
A.多元弱酸分步电离,以第一步为主,根据H2X![]() H++HX-,c(H+)=
H++HX-,c(H+)=![]() =
=![]() ≈10-3,a近似等于3,故A正确;
≈10-3,a近似等于3,故A正确;
B.点②处恰好生成NaHX,根据电荷守恒c(Na+)+c(H+)=2c(X2-)+c(HX-)+c(OH-)和质子守恒c(H+)+c(H2X)= c(X2-)+c(OH-)得:c(Na+)+2c(H+)+ c(H2X)=3 c(X2-)+ c(HX-)+2c(OH-),故B错误;
C. H2X和NaOH恰好反应生成Na2S,为中和反应的滴定终点,点④处为滴定终点,故C错误;
D.点④处恰好生成Na2X,c(Na+)>2c(X2-)>c(OH-)>c(HX-)>c(H+),故D错误;
答案:A


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
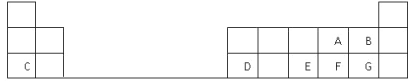
(1)画出C的原子结构示意图__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式______________________。
(6)A、C、D的简单离子半径大小关系是__________________ (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在工农业生产中具有广泛应用,请回答下列问题:
(1)基态铬原子的核外电子排布式为_____________。
(2)Cr3+能形成配离子[Cr(H2O)(H2NCH2CH2NH2)]3+,在配体H2NCH2CH2NH2 中采用 sp3杂化的原子有_____。
(3)氯化铬酰(CrO2Cl2)熔点:-96.5℃,沸点:117℃,能与 CS2 等互溶.则固态 CrO2Cl2属于________晶体。已知 NO2+与 CS2 互为等电子体,则 1molNO2+中含有π键数目为 ____________
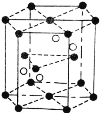
(4)Cr2O3 晶胞结构如图所示,已知 Cr2O3 的摩尔质量为 M g/mol,晶体的密度为ρ g·cm-3 ,晶胞体积为 V cm3. 晶胞结构示意图中的小黑球代表_____(填“铬离子”或“氧离子”),阿伏加德罗常数NA=_________mol-1(用含 M, V, ρ的代数式表示 )。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的分子式为C8H10,它滴入溴水中不能使溴水褪色,但它滴入酸性高锰酸钾溶液却能使其褪色。该有机物苯环上的一氯代物只有1种,则该烃是( )
A. 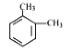 B.
B. ![]() C.
C. 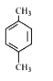 D.
D. 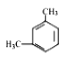
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 A 是未成熟葡萄中含有的一种物质,由 C、H、O 三种元素组成,A 在气态时的密度是相同条件下氢气密度的 38 倍。在一定条件下 A 既可以与乙醇反应生成酯又可以与乙酸反应生成酯。已知 0.1mol A 完全燃烧时生成 0.2mol CO2 和 0.2mol H2O;1mol A 可与 2mol Na 或 1mol NaOH 反应。试确定:
(1)有机物 A 的分子式_________________;
(2)写出在浓硫酸作用下,两分子 A 相互反应生成六元环状物质的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g)![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
Ⅱ.3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
则CO与H2合成气态甲醇的热化学方程式为___________________________________
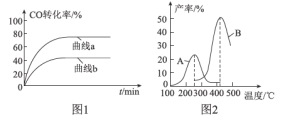
(2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500℃时,研究了n(H2):n(CO)分别为2:1、5:2时CO的转化率变化情况(如图1所示),则图中表示n(H2):n(CO)=2:1的变化曲线为___________(填“曲线a”或“曲线b”),原因是_______________________________。
(3)某科研小组向密闭容器中充入一定量的CO和H2合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是____________(填选项字母)。
a.使用催化剂A能加快相关化学反应速率,但催化剂A并未参与反应
b.在恒温恒压的平衡体系中充入氩气,CH3OH的产率降低
c.当2v(CO)正=v(H2)逆时,反应达到平衡状态
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。

若甲容器平衡后气体的压强为开始时的![]() ,则该温度下,该反应的平衡常数K=______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
,则该温度下,该反应的平衡常数K=______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
(5)CO与日常生产生活相关。
①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为__________________。
②碳酸二甲醋[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图3所示:
2(CH3O)2CO+2H2O,装置如图3所示:
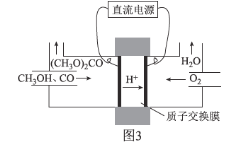
写出阳极的电极反应式:________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
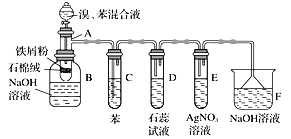
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯,发生反应。写出A中所发生反应的化学方程式:___________________________________________________________。
(2)试管观察D中看到的现象为____________________________________。
(3)在上述整套装置中,具有防倒吸作用的仪器有____________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A. 水溶液中NaHCO3电离:NaHCO3 = Na++H++CO32-
B. H2SO3电离:H2SO3![]() 2H++SO32-
2H++SO32-
C. HClO电离:HClO![]() H++ClO-
H++ClO-
D. 水溶液中NaHSO4电离:NaHSO4 = Na++HSO4-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com