
【题目】为了进一步提高合成氨的生产效率,科研中具有开发价值的是( )
A.研制高温下活性较大的催化剂
B.寻求NH3的新来源
C.研制低温下活性较大的催化剂
D.研制耐高温高压的新型材料建造合成塔
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:A、B为单质,C为淡黄色固体,A、B、C、D、E、F有如下转化关系
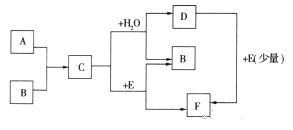
(1)写出A、B、E的化学式:
A_________________,B_________________,E___________________。
(2)完成下列化学反应方程式:
①C+H2O:__________________________________。
②D+E:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH将收制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A. 镍是阳极,电极反应为4OH--4e-=O2↑+2H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe→电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X,Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( ) 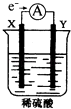
A.X极上发生的是还原反应
B.若两电极分别为Fe和碳棒,则Y为Fe
C.若反应进行一段时间后,产生2克H2时转移了1mol电子
D.溶液中的SO42﹣向X极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置. 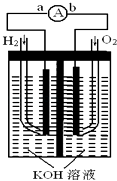
(1)电极b为该燃料电池的极(填“正”或“负”),电极方程式为;
(2)电池工作时,溶液中的OH﹣移向极(填“a”或“b”);
(3)电池工作时,在导线中电子流动方向为(用a、b表示);
(4)电池使用一段时间后,溶液的pH值(填“增大”或“减小”);
(5)当电池工作一段时间后消耗标准状况下H2为6.72L时,转移电子mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知: Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。请回答下列问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_________。
(2)用于微电子器件生产的锡粉纯度测定(已知锡的相对原子质量为119): ①取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn 完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1000mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00mL。步骤②中加入Fe2(SO4)3的作用是________;此锡粉样品中锡的质量分数为_________。若在滴定终点时俯视读数,则会导致测得的样品中锡的质量分数________(填“偏高“偏低”或“无影响”)。
(2)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤I加入Sn粉的作用:____________及调节溶液pH。
②步骤II用到的玻璃仪器有烧杯、____________。
③步骤III生成SnO的离子方程式: ____________。
④步骤IV中检验SnO是否洗涤干净的操作是____________,证明已洗净。
⑤步骤V操作依次为____________ 、____________过滤、洗涤、低温干燥。
(4)实验室欲用下图装置制备少量SnCl4(夹持装置略),该装置存在明显缺陷,改进方法是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质特征是
A. 胶体粒子带电荷 B. 胶体粒子的直径在1~100nm之间
C. 胶体粒子能够发生布朗运动 D. 胶体粒子不能穿过半透膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,关于0.1 mol·L-1 CH3COOH溶液说法正确的是( )
A. 加水稀释溶液中所有离子的浓度都减小
B. 加水稀释后溶液中 的比值减小
的比值减小
C. 加入少量氢氧化钠固体,溶液的pH增大
D. 加入少量盐酸,抑制醋酸的电离,故醋酸的电离平衡常数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com