
【题目】下列关于Fe3+、Fe2+性质实验的说法错误的是( )

A. 用如图装置可以制备Fe(OH)2沉淀
B. 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C. 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+
D. 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化还原反应反应 K2Cr2O7 + 14HCl![]() == 2KCl + 2CrCl3 + 3Cl2+ 7H2O。关于该反应的说法中正确的组合是
== 2KCl + 2CrCl3 + 3Cl2+ 7H2O。关于该反应的说法中正确的组合是
①氧化剂是K2Cr2O7②还原性:Cl->Cr3+③每生成1molCl2,电子转移为6mol④CrCl3是氧化产物
A. ①② B. ①②④ C. ①③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
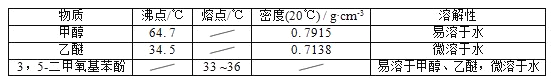
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下图甲、乙、丙均为验证铜和浓硝酸反应的装置:

(1)甲、乙、丙三个装置中共同发生的化学方程式是___________________。
(2)和甲装置相比,乙装置的优点是
①________________________________________________,
②_______________________________________________。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭活塞c,再打开活塞a、b,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该如何操作_________________。
(4)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是_____mol/L (气体体积按标准状况计算)。
II.证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性检查)

实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是__________________。
(4)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐________,得电子能力逐渐________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:

(1)元素①可与18O组成多种水分子,其相对分子质量的最大值为_____;元素①可与元素②形成一种由五个原子构成的+1价阳离子,该离子所含电子数为____________;
(2)判断:已知元素④的非金属性比⑧强,故④的单质可以从⑧的可溶性盐溶液中置换出⑧的单质___。(填“正确”或“错误”)。
(3)元素⑤⑦的最高价氧化物的水化物发生反应的化学方程式为_________;
(4)为验证VIIA族部分元素非金属性的递变规律,设计了如图装置进行实验,请回答:

①A中发生的反应的离子方程式是_______;
②棉花中浸有的NaOH溶液的作用是_______;
③VIIA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,____,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氯化铵受热固体消失和干冰升华只需克服分子间作用力
B. NaF、H2SO4中所含化学键类型相同
C. I2、Br2、Cl2、F2熔沸点逐渐升高
D. HCl气体溶于水和NaOH熔化破坏的化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:___与盐酸反应最剧烈,_____与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:__。
Ⅱ.利用图装置可验证同主族元素非金属性的变化规律
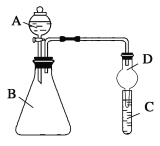
(3)仪器A的名称为____。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉—碘化钾混合溶液,观察到C中溶液____现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液_____的现象,反应的离子方程为: _____。有同学认为实验无法证明C非金属性大于Si,请指出实验设计的不足之处,并进行改进: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L醋酸溶液加水稀释,下列说法正确的是
A. 溶液中c(OH+)和c(OH-)都减小B. 溶液中c(OH+)增大
C. 醋酸电离平衡向左移动D. 溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com