
【题目】请利用下列装置及试剂组装一套装置。其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。试回答:(各装置位置未确定)
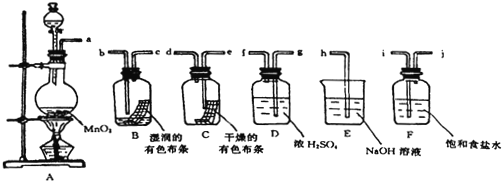
(1)烧瓶A中发生反应的化学方程式是_______________ 。
(2)E装置的作用是_______________ E装置中发生反应化学方程式是_______________。实验中若氯气的流速为每分钟2.24升,实验持续5分钟,则烧杯E中至少盛放2.5mol·L-1的氢氧化钠溶液___mL 。
(3)连接装置时,B、C的前后顺序是_______________。
(4)实验室还可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)==2KCl+ 2MnCl2+5Cl2↑ +8H2O,该反应中氧化剂和还原剂的物质的量之比为____;
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 吸收多余的氯气 Cl2+2NaOH=NaCl+NaClO+H2O 400mL 先连接C后连接B 1:5
MnCl2+Cl2↑+2H2O 吸收多余的氯气 Cl2+2NaOH=NaCl+NaClO+H2O 400mL 先连接C后连接B 1:5
【解析】
(1)烧瓶中浓盐酸与二氧化锰在加热条件下反应生成氯气、氯化锰和水,方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)氯气有毒,污染环境,所以不能直接排空;E装置的作用是:吸收多余的氯气;
氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气;E装置中发生反应化学方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;
实验中若氯气的流速为每分钟2.24升,实验持续5分钟,n(Cl2)=![]() =0.5mol,
=0.5mol,
Cl2 + 2NaOH = NaCl+NaClO+H2O
0.5mol 1mol
V(NaOH)=![]() =0.4L
=0.4L
则烧杯E中至少盛放2.5mol·L-1的氢氧化钠溶液400mL 。
(3)实验装置的连接顺序为:发生装置→除杂装置→性质检验装置→尾气处理装置;因为收集的是气体,所以除杂装置中长导管进气,短导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接饱和食盐水装置后连接浓硫酸装置;实验干燥的Cl2和潮湿的Cl2有无漂白性,因为湿润的有色布条有水分,所以D装置先连接C后连接B,顺序为a→i→j→g→f→e→d→b→c→h,
连接装置时,B、C的前后顺序是:先连接C后连接B。
(4)实验室还可以用高锰酸钾和浓盐酸反应制取氯气,2KMnO4+16HCl(浓)==2KCl+ 2MnCl2+5Cl2↑ +8H2O,该反应中氧化剂为KMnO4,还原剂是HCl,每16molHCl参加反应,还原剂只有10mol,氧化剂和还原剂的物质的量之比为2:10=1:5。


科目:高中化学 来源: 题型:
【题目】已知NH4HCO3![]() NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
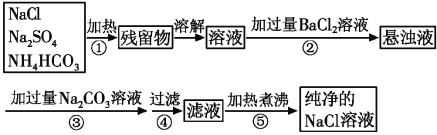
(1)操作④中所需的玻璃仪器有_________________________________。
(2)操作②为什么不用硝酸钡溶液,其理由是________________________________。
(3)进行操作②后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(4)操作③的目的是__________,其相应的离子方程式为:____________________。
(5)说明此设计方案不严密之处____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法错误的是:
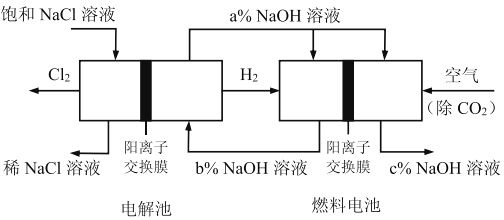
A. 电解池的阴极反应式2H2O+2e-=H2+2OH-
B. 相同条件下,当电解池生成2LCl2,理论上燃料电池应消耗1LO2
C. 电解池中阳离子移动流向阴极池
D. 溶液a、b、c的pH大小顺序为:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的液化可以合成甲醇。
①“气化”:C(s)+2H20(g)=C02(g)+2H2(g) △H1=+90.1kJ·mol-1
②催化液化Ⅰ:CO2(g)+3H2(g)=CH30H(g)+H20(g)△H2=-49.0kJ·mol-1
③催化液化Ⅱ:C02(g)+2H2(g)=CH30H(g)+1/2O2(g)△H3=akJ·mol-1
下列有关说法正确的是

A. 催化液化Ⅰ中使用催化剂,反应的活化能Ea、△H2都减小
B. 反应C(s)+H20(g)+H2(g)=CH3OH(g) △H=+41.1kJ·mol-1
C. △H2>△H3
D. 甲醇燃料电池的工作原理示意图如图所示,负极的电极反应为CH3OH-6e-+6OH-=CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用0.1mol/L的醋酸溶液滴定10.00mL 0.1mol/L的MOH溶液,滴定过程中加入醋酸溶液的体积(V)与溶液中lg[c(H+)/c(OH-)]的关系如图所示(V=0时,lg[c(H+)c(OH-)]=-12)。下列说法不正确的是
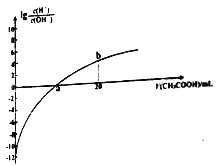
A. MOH是一元强碱
B. a 点:V(CH3COOH)=10.00mL
C. b R:c(M+)>(CH3COOH)>C(H+)>c(OH-)
D. 25℃时,CH3COO-的水解平衡常数约为5.9×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T ℃时,NH3+NH3![]() NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-14
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T ℃时,NH3+NH3![]() NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-14
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com