
【题目】下列说法正确的是
A. 分子式为C5H11Cl的同分异构体有7种
B. 分子中有两个—CH3,分子式为C5H11Cl的同分异构体有3种
C. 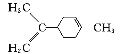 中所有碳原子一定在同一平面上
中所有碳原子一定在同一平面上
D. ![]() 中至少有16个原子共平面
中至少有16个原子共平面
【答案】D
【解析】
A、C5H11—有8种结构,故A错误;B、C5H11Cl可看作戊烷的1个H原子被Cl原子取代后的产物,戊烷有三种同分异构体,正戊烷(CH3—CH2—CH2—CH2—CH3)分子中有两个—CH3,只能是中间碳原子上的H原子被Cl原子取代,有2种情况;异戊烷(![]() )分子中有3个—CH3,必须是Cl原子取代1个—CH3上的H原子,也有2种情况;新戊烷[C(CH3)4]分子中有4个—CH3,一个Cl原子取代H原子不能满足题设要求,故满足题意的共4种同分异构体,故B错误;C、因为环状结构不是平面结构,所以所有碳原子不可能在同一平面上,故C错误;D、该分子中在同一条直线上的原子有8个,再加上其中一个苯环上的8个原子,所以至少有16个原子共平面,故D正确。
)分子中有3个—CH3,必须是Cl原子取代1个—CH3上的H原子,也有2种情况;新戊烷[C(CH3)4]分子中有4个—CH3,一个Cl原子取代H原子不能满足题设要求,故满足题意的共4种同分异构体,故B错误;C、因为环状结构不是平面结构,所以所有碳原子不可能在同一平面上,故C错误;D、该分子中在同一条直线上的原子有8个,再加上其中一个苯环上的8个原子,所以至少有16个原子共平面,故D正确。
基团 | 示例 |
心 |
|
桥 |
|
端基 |
|


科目:高中化学 来源: 题型:
【题目】甲醇是一种常见的燃料,也是重要的基础化工原料。回答下列问题:
(1)采用甲醇气相氨化法可制得二甲胺。
已知:2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) H1=-3122kJ/mol
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) H2=-472 kJ/mol
4(CH3)2NH(g)+15O2(g) 8CO2(g)+14H2O(g)+2N2(g) H3=-7492 kJ/mol
则制备二甲胺反应2CH3OH(g)+NH3(g) (CH3)2NH(g)+2H2O(g)的H=_____ kJ/mol。
(2)一定条件下,甲醇气相氨化法原料气中c(CH3OH):c(NH3)分别为1:1、2:1、3:1时,NH3的平衡转化率随温度变化的关系如图:
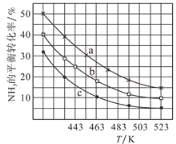
①代表原料气中c(CH3OH):c(NH3)=1:1的曲线是________。
②一定温度下,控制原料气中c(CH3OH):c(NH3)=3:1,能增大NH3平衡转化率的措施是_______。
③温度为443K时,按c(CH3OH):c(NH3)=2:1投料,若NH3的起始浓度为2mol/L,则反应达到平衡时,(CH3)2NH的体积分数为_______,该温度下的化学平衡常数为________ 。
(3)甲醇可通过电化学方法由甲烷直接制得,装置如下图所示,电解生成CH3OH的过程分为3步:

①通电时,氯离子先转化为高活性的原子氯(Cl·);
②Cl·与吸附在电极上的CH4反应生成HCl和CH3Cl;
③在碱性电解液中,CH3Cl转化为目标产物CH3OH。
步骤①的电极反应式为__________,步骤③的离子方程式为__________,维持电流强度为1.5A,装置工作2小时,理论上可制得CH3OH的质量为________g。(已知F=96500C/mol,不考虑气体溶解等因素)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的一氯代物只有4种
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图。回答下列问题。
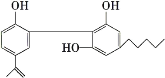
①它的化学式为____。
②从结构上看,它属于___类。
③它所含的官能团的名称是___。
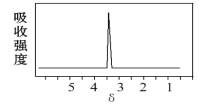
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图:则A的名称为___;请预测B的核磁共振氢谱上有___个峰(信号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中关于白铜的记载——云南镍白铜(铜镍合金),曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)Ni2+基态原子的电子排布式为_______;3d能级上的未成对电子数为____。
(2)单质铜及镍都是由 _____键形成的晶体;元素铜与镍的第二电离能分别为:Icu =1958kJmol-1、INi=1753 kJmol-1,Icu >I Ni的原因是 ________________。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验 Ni2+。
2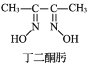 +Ni2+→
+Ni2+→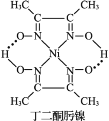 ↓+2H+
↓+2H+
①1 mol 丁二酮肟分子中含有σ 键的数目为_______mol。
②丁二酮肟镍分子中碳原子的杂化轨道类型为_____________。
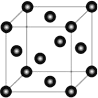
(4)Ni 的晶胞结构如图所示,镍晶体配位数目是__________ ;若 Ni 的原子半径为 d pm,Ni 的密度计算表达式是______g/cm3;Ni 原子空间利用率的计算表达式是_________。(Ni 的相对原子量用 Mr 表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Na2CO3溶液、AgNO3溶液、BaCl2 溶液、盐酸四种无色溶液中的一种,现进行了如图所示的实验。

(1)通过上述实验判断出各物质:甲___、乙___、丙___、丁____。写出甲与乙反应的离子方程式:___。
(2)实验室有一瓶标签破损(如图所示)的固体试剂。某同学应用(1)中的BaCl2溶液检验,取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确? _____(填“正确”或“不正确”)。若正确,请写出相应反应的离子方程式__________;若不正确, 请说明可能的结论:_______(填物质的化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于碳碳双键不能自由旋转,因此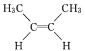 和
和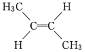 是两种不同的化合物,二者互为顺反异构体。则分子式为C3H4Cl2且含有碳碳双键的同分异构体(含顺反异构)有( )
是两种不同的化合物,二者互为顺反异构体。则分子式为C3H4Cl2且含有碳碳双键的同分异构体(含顺反异构)有( )
A. 7种B. 5种C. 6种D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.分别只用一种试剂除去下列各组中所含的少量杂质(括号内为杂质),在空格中填上需加入最适合的一种试剂:
(1)FeCl3溶液(FeCl2)________________,
(2)FeCl2溶液(FeCl3)________________,
(3)Fe 粉末(Al) _______________,
Ⅱ.为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硝酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去300 mL NaOH溶液。则所取样品中铝的物质的量为___________,反应中转移的电子数为______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中的离子平衡是中学学习的一个重要内容。请回答下列有关问题。
(1)常温下,用0.1000mol/L氨水滴定盐酸,当达到滴定终点时,溶液pH___7(填“>”、“<”或“=”),为了减小滴定误差,在滴定实验中使用的酸碱指示剂最好是___。(填字母)
A、甲基橙 B、酚酞 C、石蕊 D、以上均可
(2)常温下,将1 mL pH=12的NaOH溶液加水稀释到100mL,稀释后溶液中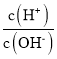 =___。
=___。
(3)某温度下,测得0.1 mol/LNaOH溶液pH为11,则该温度下水的离子积常数Kw=___。
(4)浓度相等的盐酸和醋酸各100mL,分别与过量的Zn反应,相同条件下生成H2的体积分别为V1和V2,则V1____V2(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com