
【题目】Ⅰ.分别只用一种试剂除去下列各组中所含的少量杂质(括号内为杂质),在空格中填上需加入最适合的一种试剂:
(1)FeCl3溶液(FeCl2)________________,
(2)FeCl2溶液(FeCl3)________________,
(3)Fe 粉末(Al) _______________,
Ⅱ.为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硝酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去300 mL NaOH溶液。则所取样品中铝的物质的量为___________,反应中转移的电子数为______________ 。
【答案】Cl2 Fe NaOH溶液 0.055mol 0.075NA
【解析】
Ⅰ.(1)氯气把FeCl2氧化为FeCl3;
(2)铁粉能把FeCl3还原为FeCl2;
(3)Fe 与氢氧化钠不反应, Al与氢氧化钠反应生成偏铝酸钠和氢气;
Ⅱ.镁铝合金与稀硝酸反应生成硝酸镁、硝酸铝与一氧化氮气体,向反应后的溶液中加入0.2 mol·L-1NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为NaNO3、NaAlO2,根据硝酸根守恒有n(NaNO3)=n(HNO3)- n(NO),根据钠离子守恒有n(NaOH)=n(NaNO3)+n(NaAlO2),据此计算n(NaAlO2),再根据铝原子守恒n(Al)=n(NaAlO2)计算。
Ⅰ.(1)氯气把FeCl2氧化为FeCl3,用氯气除去FeCl3溶液中FeCl2;
(2)铁粉能把FeCl3还原为FeCl2,用铁粉除去FeCl2溶液中的FeCl3;
(3)Fe 与氢氧化钠不反应, Al与氢氧化钠反应生成偏铝酸钠和氢气,用NaOH溶液除去铁粉中的铝粉;
Ⅱ. 镁铝合金与稀硝酸反应生成硝酸镁、硝酸铝与一氧化氮,向反应后的溶液中加入0.2 mol·L-1NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为NaNO3、NaAlO2,根据硝酸根守恒有n(NaNO3)=n(HNO3)- n(NO)=0.1L×0.3mol/L-![]() =0.03mol-0.025mol=0.005mol,根据钠离子守恒有n(NaOH)=n(NaNO3)+n(NaAlO2),故n(NaAlO2)=0.3L×0.2mol/L-0.005mol=0.055mol,根据铝原子守恒n(Al)=n(NaAlO2)=0.055mol;
=0.03mol-0.025mol=0.005mol,根据钠离子守恒有n(NaOH)=n(NaNO3)+n(NaAlO2),故n(NaAlO2)=0.3L×0.2mol/L-0.005mol=0.055mol,根据铝原子守恒n(Al)=n(NaAlO2)=0.055mol;
![]() ,氮元素化合价由+5变为+2,生成1molNO转移3mol电子,所以反应中转移的电子数为
,氮元素化合价由+5变为+2,生成1molNO转移3mol电子,所以反应中转移的电子数为![]() 0.075NA。
0.075NA。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】CH3COOH、H2CO3、H2SO3的电离常数如表所示。
酸 | 电离常数 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
请回答下列问题:
(1)①NaHSO3溶液中电荷守恒表达式_____。
②NaHSO3溶液中各离子浓度大小顺序:_____。
(2)①用离子方程式表示Na2CO3溶液碱性的原因_____。
②写出Na2CO3溶液中物料守恒表达式______。
③写出NaHCO3溶液中质子守恒表达式______。
(3)常温下,物质的量浓度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)从大到小排列顺序为____(填序号)。
(4)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为____(填序号)。
(5)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):____,将AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是____(填化学式)。
(6)证明CH3COOH是弱电解质的简单且可行的方法是:_____。
(7)下列混合溶液中,各离子浓度的大小顺序或等量关系正确的是____。
A.10 mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分子式为C5H11Cl的同分异构体有7种
B. 分子中有两个—CH3,分子式为C5H11Cl的同分异构体有3种
C. 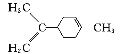 中所有碳原子一定在同一平面上
中所有碳原子一定在同一平面上
D. ![]() 中至少有16个原子共平面
中至少有16个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或物质的性质描述正确的是( )
A. 乙烯在一定条件下能发生加成反应,加聚反应,被酸性高锰酸钾溶液氧化
B. 符合分子式为C3H8O的醇有三种不同结构
C. 如图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷![]()
D. 治疗疟疾的青蒿素(如图)易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
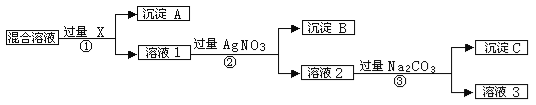
请回答下列问题:
⑴写出实验中下列物质的化学式:试剂X :_______,沉淀A:_______,沉淀B:______。
⑵上述实验流程中加入过量的Na2CO3的目的是___________________________________。
⑶按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________ ,之后若要获得固体NaNO3需进行的实验操作是________________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化阿托醛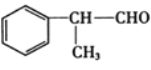 是一种重要的化工原料,其合成路线如图:
是一种重要的化工原料,其合成路线如图:
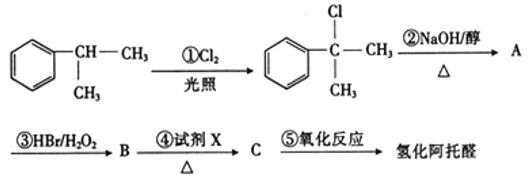
已知:HBr+CH3-CH=CH2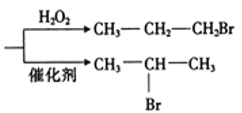
请根据上述合成路线,回答下列问题:
(1)一定条件下,1 mol氢化阿托醛最多可跟___mol氢气加成。
(2)②的反应类型是_______。写出它的化学方程式:______。
(3)④中所用试剂X为_______。
(4)写出反应⑤的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺(NH2Cl,Cl的化合价为+1价)是一种长效缓释有机氯消毒剂,它与水可以发生复分解反应。有关氯胺的说法错误的是
A.氯胺中的氮元素为-3价
B.氯胺与水反应的产物为NH2OH和HCl
C.氯胺的消毒原理与漂粉精相似
D.氯胺的消毒效率(单位质量的消毒剂得到的电子数)是Cl2的1.38倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | 33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为_______。
(2)用甲装置制氯气,MnO4 被还原为Mn2+,该反应的离子方程式为________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到_______(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;②__________。
(4)如果缺少乙装置,丁装置中可能产生SnCl2杂质,产生SnCl2杂质的化学方程式为______,以下试剂中可用于检测是否产生SnCl2的有_____
A.H2O2溶液 B.FeCl3溶液(滴有KSCN) C.AgNO3溶液 D.溴水
(5)己装置的作用是_____。
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.35gSnCl4,则SnCl4的产率为____(保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com