
【题目】CH3COOH、H2CO3、H2SO3的电离常数如表所示。
酸 | 电离常数 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
请回答下列问题:
(1)①NaHSO3溶液中电荷守恒表达式_____。
②NaHSO3溶液中各离子浓度大小顺序:_____。
(2)①用离子方程式表示Na2CO3溶液碱性的原因_____。
②写出Na2CO3溶液中物料守恒表达式______。
③写出NaHCO3溶液中质子守恒表达式______。
(3)常温下,物质的量浓度相同的下列溶液:
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④NH4HSO4 ⑤(NH4)2Fe(SO4)2
溶液中c(NH4+)从大到小排列顺序为____(填序号)。
(4)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为____(填序号)。
(5)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):____,将AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是____(填化学式)。
(6)证明CH3COOH是弱电解质的简单且可行的方法是:_____。
(7)下列混合溶液中,各离子浓度的大小顺序或等量关系正确的是____。
A.10 mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2 mol/LNaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
E.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO
【答案】c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-) c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) CO32-+H2O![]() HCO3-+OH- c(Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)] c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3) ⑤>③>④>①>② ①>③>⑤>②>④>⑥ Al3++3H2OAl(OH)3+3H+ Al2O3 用pH试纸测定醋酸钠溶液的pH值与标准比色卡比对 BE
HCO3-+OH- c(Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)] c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3) ⑤>③>④>①>② ①>③>⑤>②>④>⑥ Al3++3H2OAl(OH)3+3H+ Al2O3 用pH试纸测定醋酸钠溶液的pH值与标准比色卡比对 BE
【解析】
(1)NaHSO3溶液中含有Na+、H+、HSO3-、OH-、SO32-,则
①电荷守恒表达式c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-)。
②NaHSO3属于酸式盐,且电离程度大于水解程度,c(Na+)>c(HSO3-)>c(SO32-)。溶液显酸性,c(OH-)<c(H+),各离子浓度大小顺序:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)。
(2)①Na2CO3溶液中碳酸根水解,因此溶液显碱性的原因为:CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。
②Na2CO3溶液中c(Na+)是碳酸根离子物质的量浓度的2倍,电离水解后,碳酸根以CO32-、HCO3-、H2CO3三种形式存在,所以物料守恒表达式为c(Na+)=2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]。
③NaHCO3溶液中水电离出的c(H+)=c(OH-),在碳酸钠水溶液中水电离出的H+以(H+、HCO3-、H2CO3)三种形式存在,其中1mol碳酸分子中有2mol水电离出的氢离子,所以质子守恒表达式为c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3);
(3)NH4+易发生水解反应生成一水合氨,铵根离子浓度会减小,水解程度越大,其离子浓度越小,不同的离子对铵根离子的水解作用影响不同,促进铵根离子水解的铵根离子浓度减小,抑制铵根离子水解的铵根离子浓度较大。设以上五种溶液的浓度为1mol/L,③(NH4)2SO4、⑤(NH4)2Fe(SO4)2这两种溶液中铵根离子的起始浓度为2 mol/L,①NH4Cl、②NH4HCO3、④NH4HSO4这三种溶液中铵根离子的起始浓度为1 mol/L,故③、⑤溶液中铵根离子的浓度大于①、②、④溶液中铵根离子的浓度;③中硫酸根离子不水解对铵根离子的水解没有影响,⑤中亚铁离子的水解对铵根离子的水解起抑制作用,故这两种溶液中铵根离子的浓度大小顺序为⑤>③;②中碳酸氢根离子的水解对铵根离子的水解起促进作用,④中的氢离子对铵根离子的水解起抑制作用,①中的氯离子不水解对铵根离子的水解无影响,故这三种溶液中铵根离子的浓度大小顺序为④>①>②,综上分析,上述五种溶液中铵根离子浓度的大小顺序为⑤>③>④>①>②;
(4)①NaOH为强碱;⑥H2SO4为强酸;②NaCl为强酸强碱盐;④H2SO3为弱酸;③Na2CO3和⑤CH3COONa为弱酸强碱盐,醋酸的酸性比碳酸强,碳酸根离子水解程度大于醋酸根离子,溶液碱性强;所以其pH从大到小排列顺序为:①>③>⑤>②>④>⑥;
(5)AlCl3为强酸弱碱盐,水解呈酸性,Al3+水解离子方程式为:Al3++3H2OAl(OH)3↓+3H+;溶液蒸干,氯化氢挥发促进水解正向进行得到氢氧化铝,再灼烧氢氧化铝分解得到氧化铝。
(6)若醋酸钠为强酸强碱盐,那么其水溶液为中性pH=7,用pH试纸测到醋酸钠溶液的pH值,醋酸钠溶液显碱性,说明醋酸根会水解,也就是说醋酸是弱酸。
(7)A. 等浓度、等体积的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐其溶液呈酸性,所以c(H+)>c(OH),溶液中正确的离子浓度大小为:c(Cl)>c(NH4+)>c(H+)>c(OH),故A错误;
B. 等物质的量的氯化铵和氢氧化钠溶液混合,二者恰好反应生成等物质的量的氯化钠和一水合氨,溶液呈碱性,则c(OH)>c(H+),根据物料守恒知:c(Na+)=c(Cl),则溶液中离子浓度关系为:c(Na+)=c(Cl)>c(OH)>c(H+),故B正确;
C. 等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠和水,醋酸钠是强碱弱酸盐,其溶液呈碱性,所以c(OH)>c(H+),醋酸钠溶液中c(CH3COO)>c(OH),根据电荷守恒得c(Na+)>c(CH3COO),所以离子浓度大小顺序为:c(Na+)>c(CH3COO)>c(OH)>c(H+),故C错误;
D. 醋酸钠和盐酸混合,醋酸钠的物质的量小于盐酸,二者混合有溶液中的溶质是醋酸、氯化钠和盐酸,溶液呈酸性,则c(H+)>c(OH),溶液中正确的离子浓度关系为:c(Cl)>c(Na+)>c(H+)>c(OH),故D错误;
E.在NaHSO4强酸强碱盐,溶液中完全电离为Na+、H+、SO42-,且c(H+)=c(SO42-)=c(Na+),根据电荷守恒可知c(H+)=c(OH-)+c(SO42-),故E正确。
答案选BE。


科目:高中化学 来源: 题型:
【题目】将2molNaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后,对所得固体进行测定,发现Na2O2无剩余,则所得固体的物质的量(n)为
A.1mol<n<2molB.1mol<n<4mol
C.2mol<n≤4molD.1mol<n≤4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种常见的燃料,也是重要的基础化工原料。回答下列问题:
(1)采用甲醇气相氨化法可制得二甲胺。
已知:2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g) H1=-3122kJ/mol
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) H2=-472 kJ/mol
4(CH3)2NH(g)+15O2(g) 8CO2(g)+14H2O(g)+2N2(g) H3=-7492 kJ/mol
则制备二甲胺反应2CH3OH(g)+NH3(g) (CH3)2NH(g)+2H2O(g)的H=_____ kJ/mol。
(2)一定条件下,甲醇气相氨化法原料气中c(CH3OH):c(NH3)分别为1:1、2:1、3:1时,NH3的平衡转化率随温度变化的关系如图:
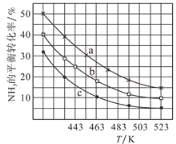
①代表原料气中c(CH3OH):c(NH3)=1:1的曲线是________。
②一定温度下,控制原料气中c(CH3OH):c(NH3)=3:1,能增大NH3平衡转化率的措施是_______。
③温度为443K时,按c(CH3OH):c(NH3)=2:1投料,若NH3的起始浓度为2mol/L,则反应达到平衡时,(CH3)2NH的体积分数为_______,该温度下的化学平衡常数为________ 。
(3)甲醇可通过电化学方法由甲烷直接制得,装置如下图所示,电解生成CH3OH的过程分为3步:

①通电时,氯离子先转化为高活性的原子氯(Cl·);
②Cl·与吸附在电极上的CH4反应生成HCl和CH3Cl;
③在碱性电解液中,CH3Cl转化为目标产物CH3OH。
步骤①的电极反应式为__________,步骤③的离子方程式为__________,维持电流强度为1.5A,装置工作2小时,理论上可制得CH3OH的质量为________g。(已知F=96500C/mol,不考虑气体溶解等因素)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示转化关系中涉及到的物质均由主族元素组成(部分产物已略去),其中C、D为单质,A、B、E、F、G为化合物,除C与D的反应外,其它反应均在溶液中进行。请填写下列空白。
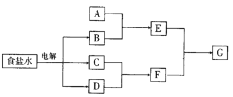
(1) 若A是常见的金属或金属氧化物,当F过量时,G为可溶性盐,则A的化学式为_________或_________。
(2) 若A是一种常见氧化物,不管F过量与否,G为同一种难溶性物质,则A的名称是________,晶体类型是_______,A的用途是_________。
(3) 若A是一种具有漂白性的气态氧化物,A是___;若A是一种无味的气态氧化物,A的电子式为______。
(4) 若A为有机化合物,如果A与G为同一物质,请写出两种A(不同类别物质)的结构简式:_____;_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24 L CHCl3 所含共价键数为0.4NA
B.常温常压下,2 g羟基(18OD)所含的中子数为NA
C.常温常压下,1.5 g NO与1.6 g O2充分反应后混合物中原子总数为0.2NA
D.常温下,2 L 0.1 molL-1FeCl3 溶液与1 L 0.2 molL-1FeCl3 溶液所含Fe3+数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
I.可利用CH4与CO2制备合成气(CO、H2),在某一钢性密闭容器中CH4、CO2的分压分别为15kPa、20kPa,加入Ni/α-A12O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)=2CO(g)+2H2(g)
(1)研究表明CO的生成速率![]() ,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
,某时刻测得p(H2)=10kPa,则该时刻v(CH4)=___________k·Pas-1。
(2)达到平衡后,测得CO的产率为50%,则该反应的平衡常数Kp=_________。
(3)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
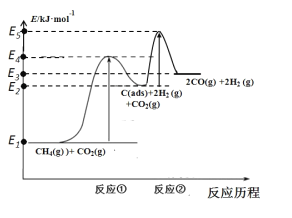
CH4与CO2制备合成气的热化学方程式为__________________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.CO2催化加氢制甲醇5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2,发生以下反应:
i. ![]() ,
,![]()
ii.. ![]()
iii. ![]()
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如右图所示。
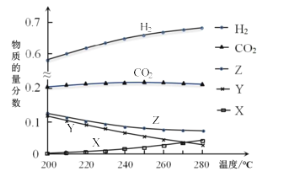
(4)①体系中CO2的物质的量分数受温度的影响不大,原因是_______________________。
②下列措施中,无法提高甲醇平衡产率的是________(填标号)。
A.加入适量CO B.增大压强C.循环利用原料气D.升高温度
③如上图X、Y分别代表_________、________(填化学式)。
III.利用铜基配合物1,10-phenanthroline-Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
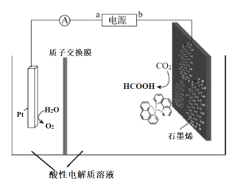
(5)①电池工作过程中,图中Pt电极附近溶液的pH_______(填“变大”或“变小”),阴极的电极反应式为________________。
②每转移2mol电子,阴极室溶液质量增加______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的一氯代物只有4种
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)运动员服用兴奋剂的现象在世界大赛中时有发生,某种兴奋剂的结构如图。回答下列问题。
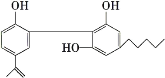
①它的化学式为____。
②从结构上看,它属于___类。
③它所含的官能团的名称是___。
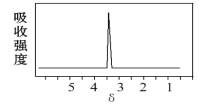
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图:则A的名称为___;请预测B的核磁共振氢谱上有___个峰(信号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.分别只用一种试剂除去下列各组中所含的少量杂质(括号内为杂质),在空格中填上需加入最适合的一种试剂:
(1)FeCl3溶液(FeCl2)________________,
(2)FeCl2溶液(FeCl3)________________,
(3)Fe 粉末(Al) _______________,
Ⅱ.为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硝酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1 NaOH溶液至沉淀质量恰好不再变化,用去300 mL NaOH溶液。则所取样品中铝的物质的量为___________,反应中转移的电子数为______________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com