
【题目】美国科学家目前开发出了一种新技术,将能放射出![]() 粒子的砹原子装入形状类似DNA螺旋结构的碳纳米管中,这种肉眼看不见的微型“核弹”可以搜索、确认并定向摧毁身体任何部位的癌细胞.下列有关说法中正确的是( )
粒子的砹原子装入形状类似DNA螺旋结构的碳纳米管中,这种肉眼看不见的微型“核弹”可以搜索、确认并定向摧毁身体任何部位的癌细胞.下列有关说法中正确的是( )
A.放射性At原子中,核外电子与核内中子数之差为133
B.根据元素周期律推知:砹单质是![]() 种有色固体,AgAt是一种不溶于水的固体
种有色固体,AgAt是一种不溶于水的固体
C.类似DNA螺旋结构的碳纳米管是一种高分子化合物
D.构成碳纳米管的微粒直径在![]() 之间,它实际上是一种胶体
之间,它实际上是一种胶体
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 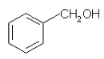 与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 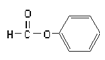 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的分子式为C4H8O2,其转化关系如图所示:
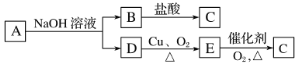
(1)D的名称是_______________。
(2)有机物A与NaOH溶液反应的化学方程式是_________________________________。
(3)下列说法不正确的是。______________
A.B→C的反应属于加成反应
B.等质量的A和E完全燃烧,消耗的O2的量相同
C.可用银氨溶液鉴别D和E
D.C和D都可以和Na发生反应
(4)E→C的反应类型是______________。
(5)写出乙烯和C反应生成A(该反应原子利用率达到100%)的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
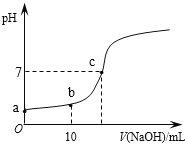
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是____。
(2)用标准的NaOH溶液滴定待测的盐酸时,左手握_______(填“酸式”或“碱式”)滴定管的活塞,右手摇动锥形瓶,眼睛注视_______________判断滴定终点的现象是____________________。
(3)若测定结果偏高,其原因可能是_____。
a.配制标准溶液的固体NaOH中混有KOH杂质
b.滴定终点读数时,仰视滴定管的刻度,其他操作正确
c.盛装待测液的锥形瓶用蒸馏水洗过后未用待测液润洗
d.滴定管滴定前无气泡,滴定后有气泡
(4)如图是某次滴定时的滴定管中的液面,其读数为_____mL。
![]()
(5)根据下列数据,请计算待测盐酸的浓度:_________mol·L-1。
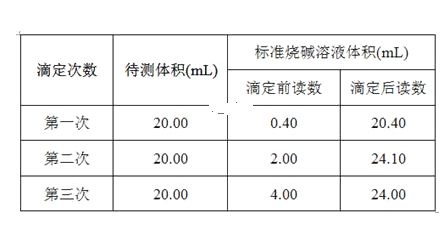
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,![]() 的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是![]()

A.简单离子半径:![]()
B.Y与W形成的化合物分子可能是非极性分子
C.基态原子的第一电离能:![]()
D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某气态烃A的密度是1.25g·L-1,取x L的A在足量的氧气中充分燃烧,生成的混合气体通入到50mLNaOH溶液,随后取此溶液25mL将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的HCl溶液,产生的CO2气体体积与所加入的盐酸的体积之间的关系如图所示:
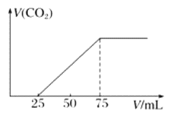
(1)A的摩尔质量为________________。
(2)请计算x的值(写出具体计算过程)。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0、ΔS>0
B.加热Na2CO3溶液,![]() 增大
增大
C.由热化学方程式2CO(g)+O2(g)=2CO2 (g)ΔH=-566 kJ·mol-1可知,CO的燃烧热是566 kJ·mol-1
D.中和等体积、等浓度的醋酸和盐酸,醋酸消耗的NaOH的物质的量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、M、W的原子序数依次递增,X的简单阴离子与He原子具有相同的电子层结构,Y基态原子未成对电子数在所处周期中最多,M是地壳中含量最多的金属元素,W原子最外层电子数是K层电子数的3倍,Z、W同主族。
(1)下列说法正确的是______。
A.原子半径:![]()
B.X、Y、Z三种元素只能形成共价化合物
C.W的简单气态氢化物的热稳定性比Z的强
D.M的单质能溶于W的最高氧化物对应水化物的稀溶液
(2)X、Y、Z、M、W五种元素中:
①电负性最小的元素是______![]() 填元素的符号,下同
填元素的符号,下同![]() ,第一电离能最大的元素是______。
,第一电离能最大的元素是______。
②Z原子的电子排布图![]() 轨道表示式
轨道表示式![]() 为______,W的电子排布式为______。
为______,W的电子排布式为______。
③如图可以表示Y单质分子中电子云重叠方式的是______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
1molY单质分子中含有![]() 键的数目为______。
键的数目为______。
④Y的简单气态氢化物极易溶于水,其原因是______;一种含碳元素的阴离子R与Y的简单气态氢化物互为等电子体,写出R的电子式:______。
⑤向W的简单气态氢化物的水溶液中通入Z的单质,有W的单质析出,可以验证Z的非金属性强于W,该反应的离子方程式为______。
(3)向含有M简单离子的溶液中加入过量NaOH溶液,可生成![]() 。
。
①不考虑空间构型![]() 要标出配位键,M要用元素符号表示
要标出配位键,M要用元素符号表示![]() ,
,![]() 的结构可用示意图表示为______。
的结构可用示意图表示为______。
②![]() 的空间构型为______,其M原子轨道的杂化类型为______。
的空间构型为______,其M原子轨道的杂化类型为______。
(4)铁、铜和Y元素可生成晶胞结构图1所示的化合物,该化合物的化学式为______。
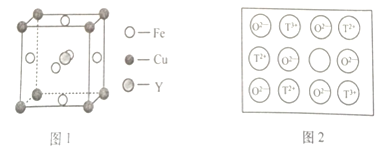
![]() 天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷
天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷![]() 如图2所示
如图2所示![]() 。
。
①基态![]() 的外围电子排布式为______;若该T的氧化物晶体中每有1个
的外围电子排布式为______;若该T的氧化物晶体中每有1个![]() 空缺,则应有______个
空缺,则应有______个![]() 倍
倍![]() 所取代,才能使晶体仍呈电中性。
所取代,才能使晶体仍呈电中性。
②若某T的氧化物晶体样品中![]() 与
与![]() 的离子数之比为1:11,则该晶体的化学式为______。
的离子数之比为1:11,则该晶体的化学式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com