
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
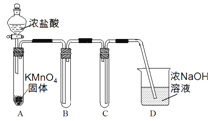
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。
【答案】收集氯气 防止D中的溶液进入B Cl2 、Cl—、ClO—、HClO Cl2 + H2O![]() HClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强 CaCO3+2Cl2 +H2O==2 HC1O + CO2+ CaCl2 其他条件相同时,氢离子浓度不同对化学反应速率的影响 5 收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化
HClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强 CaCO3+2Cl2 +H2O==2 HC1O + CO2+ CaCl2 其他条件相同时,氢离子浓度不同对化学反应速率的影响 5 收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化
【解析】
试题(1)氯气的密度比空气大,用向上排空气法收集,所以装置B的作用为收集氯气,氯气有毒,用NaOH溶液进行尾气吸收,为防止倒吸,装置C的作用是防止D中的溶液进入B。
(2)氯气溶于水并与水发生反应,Cl2+H2O![]() H++Cl-+HClO,得到的氯水呈黄绿色,说明含有Cl2,所以饱和氯水中含氯元素的微粒有Cl—Cl2ClO—HClO。
H++Cl-+HClO,得到的氯水呈黄绿色,说明含有Cl2,所以饱和氯水中含氯元素的微粒有Cl—Cl2ClO—HClO。
(3)①Cl2 + H2O![]() HClO+HCl;CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强,所以在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
HClO+HCl;CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强,所以在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
②根据上述现象,饱和氯水与石灰石反应生成HC1O的方程式是CaCO3+2Cl2 +H2O==2 HC1O + CO2+ CaCl2。
(4)①根据表格提供的信息,该反应在常温下进行,温度相同,每次试验时,氯酸钾溶液和氯化钾溶液的浓度相同,只有硫酸的用量不同,即氢离子浓度不同,所以该系列实验的目的是其他条件相同时,氢离子浓度不同对化学反应速率的影响;
②根据表格提供的信息,混合溶液的总体积均为9mL,所以烧杯3取用硫酸的体积应为9-1-3=5mL。
(5)因为ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色,所以要验证Cl2中是否含有ClO2,简单的操作为收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化即可。


科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生反应:![]() 。2 min末该反应达到平衡,测得生成0.8 mol D、0.4 mol C。下列判断不正确的是
。2 min末该反应达到平衡,测得生成0.8 mol D、0.4 mol C。下列判断不正确的是
A.![]() =1
=1
B.2 min时,A的浓度为0.9 mol·L-1
C.2 min时,A的平均反应速率为0.3 mol·L-1·min-1
D.2 min时,B的平均反应速率为0.9 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国科学家研制出以石墨烯为载体的催化剂,在 25℃下用 H2O2 直接将 CH4转化为含氧有机物,其主要原理如下图所示:
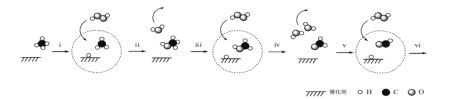
下列说法不正确的是
A.上图中 ![]() 代表 H2O2
代表 H2O2
B.由上图可知,步骤 iv 生成的 H2O,其中的 H 原子全部来自 H2O2
C.步骤 i、ii 的总反应方程式是CH4+H2O2![]() CH3OH+H2O
CH3OH+H2O
D.根据以上原理,推测步骤 vi 生成 HCOOH 和 H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机中生成 NO 的反应为:N2(g) + O2(g)![]() 2NO(g),t℃时,K= 0.09。在 t℃下甲、乙、丙三个恒容密闭容器中,投入 N2(g)和 O2(g)模拟反应,起始浓度如下表所示。
2NO(g),t℃时,K= 0.09。在 t℃下甲、乙、丙三个恒容密闭容器中,投入 N2(g)和 O2(g)模拟反应,起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(N2)/mol·L-1 | 0.46 | 0.46 | 0.92 |
c(O2)/mol·L-1 | 0.46 | 0.23 | 0.92 |
下列判断不正确的是
A.起始时,反应速率:丙>甲>乙B.平衡时,N2 的转化率:甲>乙
C.平衡时,c(NO):甲=丙>乙D.平衡时,甲中 c(N2)= 0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-)
D.④中:c(![]() ) + 2c(
) + 2c(![]() ) + c(H2CO3) 0.1 mol/L
) + c(H2CO3) 0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2℃时,向25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如图所示。下列说法正确的是( )
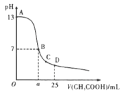
A.在A、B间任一点的溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.用含a的代数式表示CH3COOH的电离平衡常数K=![]()
C.C点对应的溶液中,水电离出的H+浓度大于10-7 mol/L
D.D点对应的溶液中,存在关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
![]()
A.原子半径大小:W>Y>Z
B.X的氢化物与Z的氢化物可以发生反应
C.氧化物对应水化物的酸性:Z>Y>W
D.氢化物的稳定性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是( )
A.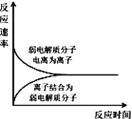 表示弱电解质在水中建立电离平衡的过程
表示弱电解质在水中建立电离平衡的过程
B.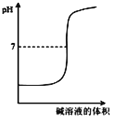 表示强碱滴定强酸的滴定曲线
表示强碱滴定强酸的滴定曲线
C.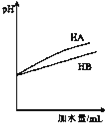 表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D.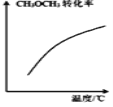 表示密闭容器中
表示密闭容器中![]() 达到平衡后,恒压升高温度过程中,
达到平衡后,恒压升高温度过程中,![]() 的转化率变化趋势
的转化率变化趋势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列有关胆矾的说法正确的是( )
A. Cu2+的价电子排布式为3d84s1
B. 所有氧原子都采取sp3杂化
C. 氧原子参与形成离子键、配位键和氢键三种化学键
D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com